题目内容
硫酸铜受热分解生成氧化铜和气体,加热温度不同,气体成分也不同。气体成分可能含SO2、SO3和O2中的一种、两种或三种。某化学课外活动小组通过设计探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验用到的仪器如下图所示:
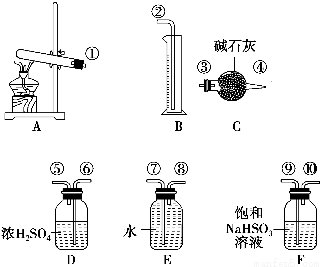
[提出猜想]
Ⅰ.所得气体的成分可能只含SO3一种;
Ⅱ.所得气体的成分可能含有________两种;
Ⅲ.所得气体的成分可能含有________三种。
[实验探究]
实验操作过程略。已知实验结束时,硫酸铜完全分解。
(1)请你组装探究实验的装置,按从左至右的方向,各仪器接口的连接顺序为①→⑨→⑩→⑥→⑤→________→________→________→________→②(填接口序号)。
(2)若实验结束时B中量筒没有收集到水,则证明猜想________正确。
(3)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后测得相关数据也不同,数据如下:
实验 小组 | 称取CuSO4 的质量/g | 装置C增加 的质量/g | 量筒中水的体积折算成标准状况下气体的体积/mL |
一 | 6.4 | 2.56 | 448 |
二 | 6.4 | 2.56 | 224 |
请通过计算,推断出第一小组和第二小组的实验条件下CuSO4分解的化学方程式。
第一小组:________________________________________________________;
第二小组:________________________________________________________。
Ⅱ.SO2、O2 Ⅲ.SO2、SO3、O2
(1)③ ④ ⑧ ⑦ (2)Ⅰ
(3)2CuSO4 2CuO+2SO2↑+O2↑ 4CuSO4
2CuO+2SO2↑+O2↑ 4CuSO4 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑
【解析】本题考查硫酸铜分解产物的实验探究。氧化还原反应中化合价有升必有降,如果产物中只有两种气体,必为SO2、O2的混合物;如果有三种气体,则必为SO2、SO3、O2的混合物。(1)SO3溶于水生成硫酸,硫酸会与F中NaHSO3溶液反应生成SO2,通过浓硫酸干燥后,再通过碱石灰的增重情况可测定二氧化硫的质量,通过E、B装置所测气体的体积就是氧气的体积。(2)若B中量筒中没有收集到水,则说明实验中没有生成O2即猜想Ⅰ正确。(3)根据氧化还原反应中得失电子守恒,硫酸铜分解产生的SO2与O2的物质的量之比必为2∶1。实验中,如果产生的SO2与O2的物质的量之比不是2∶1,则说明分解产物中还含有SO3。第一小组:n(CuSO4)=0.04 mol,n(O2)=0.02 mol,n(SO2)=2.56 g÷64 g·mol-1=0.04 mol,SO2与O2的物质的量之比为2∶1,所以该小组硫酸铜分解的产物是CuO、SO2、O2。第二小组:n(CuSO4)=0.04 mol,n(O2)=0.01 mol,n(SO2)=0.04 mol,说明硫酸铜分解时还生成了0.02 mol SO3,据此即可写出反应的化学方程式。