题目内容
【题目】影响化学反应速率的因素很多,同学们用以下实验的进行探究。
(1)实验一:经研究知Fe3+、Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验(其它实验条件相同)。
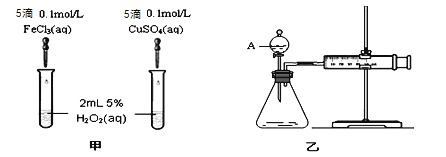
①定性分析:如图甲可通过观察产生气泡的快慢来比较反应速率的大小,比较得出结论。若图甲所示的实验中反应速率为左边>右边,能否一定说明Fe3+比Cu2+对H2O2分解的催化效果更好 (填“能”或“否”),其理由是____________________(若能说明催化效果,此空不填) 。
②定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。用简单的方法检验该装置的气密性 。实验中需要测量的数据是: 。
(2)实验二:高锰酸钾酸性(稀硫酸酸化)溶液和草酸(H2C2O4)溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显但不久突然褪色,反应速率明显加快。
① 写出酸性高锰酸钾溶液和草酸溶液反应的化学方程式: 。
②针对上述实验现象,某同学认为KMnO4与草酸的反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是 的影响。
若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是 。(填序号)
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰
(3)实验三 已知 KI溶液在酸性条件下能与氧气反应。 现有以下实验记录:
实验编号 | ① | ② | ③ | ④ | ⑤ |
温度(℃) | 30 | 40 | 50 | 60 | 70 |
显色时间(s) | 160 | 80 | 40 | 20 | 10 |
① 该反应的离子方程式为_____________________。
② 完成此实验,试剂除了1 mol/L KI溶液、0.1 mol/L H2SO4溶液外,还需要的试剂是______________,
实验现象为 。
③ 由上述实验记录数据可得出的结论是_________________。
【答案】
(1)①否(1分)。两催化剂的阴离子不同(其它合理答案也可)(1分)
②关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,如活塞复原则装置的气密性良好。(2分)(合理即可) 产生40mL气体所需的反应时间。(1分)
(2)①2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑(没配平不给分)(2分)
②催化剂(或硫酸锰、Mn2+)(1分) B(1分)
(3)① 4H++4I-+O2=2I2+2H2O(2分)
② 淀粉溶液(1分)、无色溶液变蓝色(1分)
③ 其他条件不变,每升高10℃,反应速率大增大2倍(2分
【解析】
试题分析:
(1)① 甲中加入的催化剂为FeCl3,乙中加入的催化剂为CuSO4,两者的阴、阳离子都不相同,根据可知变量法,每次只能改变一个量,则不能说明Fe3+比Cu2+对H2O2分解的催化效果更好。
②检验该装置的气密性的方法是:关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,如活塞复原则装置的气密性良好。实验中需要测量的数据是:产生40mL气体所需的反应时间。
(2)①酸性高锰酸钾溶液和草酸溶液反应的化学方程式为2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑
②实验过程中发现开始一段时间,反应速率较慢,溶液褪色不明显但不久突然褪色,反应速率明显加快。原因可能是温度升高,反应速率加快;也可能是生成的Mn2+对反应有催化作用。可通过做对照实验,加入硫酸锰来证明猜想。
(3)①根据氧化还原反应类型离子方程式要遵循原子守恒、电荷守恒和得失电子数目相等,该反应的离子方程式为4H++4I-+O2=2I2+2H2O。
②根据表中数据分析,该实验目的是探究温度对反应速率的影响,为测定显色时间,产物中有碘单质生成,还需要的试剂是淀粉溶液,实验现象为无色溶液变蓝色。③分析实验数据可得出的结论是其他条件不变,每升高10℃,反应速率大增大2倍。

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案