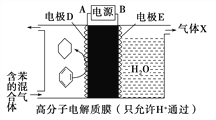
题目内容
【题目】常温下,CaSO4(s)+CO32-![]() CaCO3(s)+SO42-的平衡常数K=1.75×104,已知常温下,饱和CaSO4溶液中c( Ca2+) = 0.70×10-2mol/L,则常温时CaCO3的Ksp为
CaCO3(s)+SO42-的平衡常数K=1.75×104,已知常温下,饱和CaSO4溶液中c( Ca2+) = 0.70×10-2mol/L,则常温时CaCO3的Ksp为
A. 2.50×10-8 B. 0.40×10-6
C. 2.80×10-9 D. 0.4×10-9
【答案】C
【解析】
已知饱和CaSO4溶液中c(Ca2+)=_0.70×10-2mol/L,Ksp(CaSO4)=c(Ca2+)×c(SO42-)=4.9×10-5mol/L,反应CaSO4(s)+CO32-![]() CaCO3(s)+SO42-可由①CaSO4(s)
CaCO3(s)+SO42-可由①CaSO4(s)![]() Ca2++SO42-,②CaCO3(s)
Ca2++SO42-,②CaCO3(s)![]() Ca2++CO32-,经①-②得到,即K=c(SO42-)÷c(CO32-)=Ksp(CaSO4)÷Ksp(CaCO3)=1.75×104,故Ksp(CaCO3)=2.80×10-9,故答案为C。
Ca2++CO32-,经①-②得到,即K=c(SO42-)÷c(CO32-)=Ksp(CaSO4)÷Ksp(CaCO3)=1.75×104,故Ksp(CaCO3)=2.80×10-9,故答案为C。

练习册系列答案
相关题目