题目内容
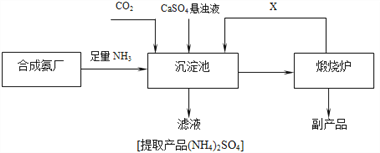
【题目】作催熟剂的物质除乙烯外,还有氯酸镁。实验室制备少量氯酸镁晶体【Mg(ClO3)2·6H2O】的流程如下:
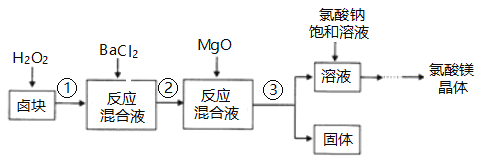

(1)步骤③的操作名称是___________,该步分离出的固体中含有多种成分,任写出一种成分的化学式____________________。
(2)用双氧水溶解卤块,H2O2的主要作用是___________________。
(3)加入饱和氯酸钠溶液发生的主要反应的反应类型是_________________(填四大基本反应类型)。
(4)若卤块中MgCl2·6H2O含量为81.2%,用10L饱和氯酸钠溶液(其中溶质利用率为90%),理论上可以制得氯酸镁晶体的质量是___________(用带a的代数式表示)。
【答案】 过滤 BaSO4或Fe(OH)3 (其它合理答案均可) 将Fe2+氧化为Fe3+ 复分解反应 1345.5ag
【解析】卤块的成分有MgCl26H2O、MgSO4、FeCl2,加入双氧水之后,亚铁离子可以被氧化为三价铁离子,再向混合物中加入氯化钡溶液,可以将硫酸根离子转化为硫酸钡沉淀,加入氧化镁,调节pH=4,可以促进铁离子的水解,将铁离子转化为氢氧化铁而除去,过滤,得到的滤液是氯化镁,可以根据溶解度受温度的影响情况来获得要制取的物质;
(1)步骤③是将溶液中不溶性固体除去,此操作应为过滤,分离出的固体为反应中生成的BaSO4或Fe(OH)3沉淀;
(2)用双氧水溶解卤块,利用H2O2的氧化性,将Fe2+氧化为Fe3+;
(3)加入饱和氯酸钠溶液生成氯酸镁,反应类型是复分解反应;
(4)利用原子守恒可知理论上可以制得氯酸镁晶体的质量是10L×amol/L×90%×![]() ×299g/mol=1345.5ag。
×299g/mol=1345.5ag。

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目