题目内容
【题目】(15分)周期表前四周期的元素X、Y、Z、T、W,原子序数依次增大。X的核外电子总数与其周期数相同,Y基态原子的p电子数比s电子数少1个,Z基态原子的价电子层中有2个未成对电子,T与Z同主族,W基态原子的M层全充满,N层只有一个电子。回答下列问题:
(1)Y、Z、T中第一电离能最大的是 (填元素符号,下同),原子半径最小的是 。
(2)T的原子结构示意图为 ,W基态原子的电子排布式为 。
(3)X和上述其他元素中的一种形成的化合物中,分子呈三角锥形的是 (填化学式);分子中既含有极性共价键,又含有非极性共价键的化合物是 (填化学式,写一种)。
(4)T与Z形成的化合物中,属于非极性分子的是 (填化学式)。
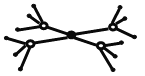
(5)这5种元素形成的一种阴阳离子个数比为1:1型的配合物中,阴离子呈四面体结构,阳离子的结构如图所示。该配合物的化学式为 ,阳离子中存在的化学键类型有 。
【答案】(1)N O (各1分) (2)![]() (1分) [Ar]3d104s1(2分)
(1分) [Ar]3d104s1(2分)
(3)NH3 (2分) H2O2或N2H4 (2分) (4)SO3 (2分)
(5)[Cu(NH3)4]SO4 (2分) 共价键、配位键(2分)
【解析】
试题周期表前四周期的元素X、Y、Z、T、W,原子序数依次增大。X的核外电子总数与其周期数相同,则X是氢元素。Y基态原子的p电子数比s电子数少1个,则Y应该是氮元素。Z基态原子的价电子层中有2个未成对电子,所以Z是氧元素。T与Z同主族,则T是S元素。W基态原子的M层全充满,N层只有一个电子,则W是Cu元素。
(1)非金属性越强,第一电离能越大。但氮元素的2p轨道电子处于半充满状态,稳定性强,则氮元素的第一电离能大于氧元素的。同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则原子半径最小的是O。
(2)S的原子序数是16,原子结构示意图为![]() 。根据核外电子排布规律可知W基态原子的电子排布式为[Ar]3d104s1。
。根据核外电子排布规律可知W基态原子的电子排布式为[Ar]3d104s1。
(3)X和上述其他元素中的一种形成的化合物中,分子呈三角锥形的是NH3。分子中既含有极性共价键,又含有非极性共价键的化合物是H2O2或N2H4。
(4)T与Z形成的化合物中,SO2是V形结构,三氧化硫是平面三角形,则属于非极性分子的是SO3。
(5)这5种元素形成的一种阴阳离子个数比为1:1型的配合物中,阴离子呈四面体结构,则为硫酸根。阳离子的结构如右图所示,即为氨气和铜离子形成的配位健,则该配合物的化学式为[Cu(NH3)4]SO4,阳离子中存在的化学键类型有配位健及氮元素与氢原子之间的共价键。

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
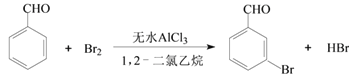
激活思维智能训练课时导学练系列答案【题目】实验室以苯甲醛为原料制备间溴苯甲醛的反应如下:
已知:①间溴苯甲醛温度过高时易被氧化。②溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点及相对分子质量见下表:
物质 | 溴 | 苯甲醛 | 1,2-二氯乙烷 | 间溴苯甲醛 |
沸点/℃ | 58.8 | 179 | 83.5 | 229 |
相对分子质量 | 160 | 106 | 185 |
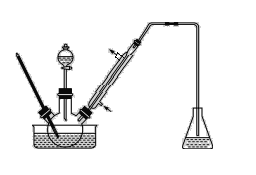
步骤1:将一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后装入三颈烧瓶(如图所示),缓慢滴加经浓硫酸干燥过的足量液溴,控温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机层用10% NaHCO3溶液洗涤。
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤出MgSO4nH2O晶体。
步骤4:分离有机层,收集相应馏分。
(1)实验装置中盛装液溴的仪器名称是_____,锥形瓶中的试剂为NaOH溶液其作用为________。
(2)步骤1反应过程中,为提高原料利用率,适宜的温度范围为(填序号)___。
A.>229℃ B.58.8℃~179℃ C.<58.8℃
(3)步骤2中用10% NaHCO3溶液洗涤,是为了除去溶于有机层的___(填化学式)。
(4)步骤4中采用何种蒸馏方式_______,其目的是为了防止________。
(5)若实验中加入了5.3 g苯甲醛,得到3.7 g间溴苯甲醛。则间溴苯甲醛产率为______。