��Ŀ����
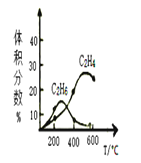
����Ŀ��X��Y��Z��J��Q��WΪǰ������Ԫ�أ�ԭ��������������Ԫ��Y�ڵؿ��к�����ߣ�W��һ�ֳ������������Ǻ���ɫ��ĩ�����������ᡢͿ�ϡ���ī�ĺ�ɫȾ�ϣ�25��X��Z��J��Q������������Ӧˮ������Һ(Ũ�Ⱦ�Ϊ0��01mol��L-1)��pH��ԭ�������Ĺ�ϵ��ͼ��ʾ��

����������Ϣ�����жϣ����ش��������⣺
��1��W�����ڱ��е�λ��__���Ƚ�X��Y��Z�ļ����Ӱ뾶��СΪ__��____��__(�����ӷ��ű�ʾ)��
��2��Ԫ�صķǽ�����Y__J(���������)�����и����У�����˵����һ���۵���__(�����)��
A��J���⻯���ˮ��Һ�����ڿ����л�����
B��Y��J֮���γɵĻ�������Ԫ�صĻ��ϼۡ�
C��Y��J�ĵ��ʵ�״̬
D��Y��J�����ڱ��е�λ��
��3��X��J��Q��ЩԪ���γɵĺ������У����ӵ�����ԭ�ӵļ۲���Ӷ���Ϊ3������_____(�ѧʽ)������������ṹ������___(�ѧʽ)��
��4��Y��Q�γɵĻ�����Q2Y�����幹��Ϊ__��Q�ĵ�����ʪ���Na2CO3��Ӧ���Ʊ�Q2Y���仯ѧ����ʽΪ___��
���𰸡��������ڢ��� Na+ O2- N3- > C HNO2��HNO3 H2SO3��HClO3 V�� 2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl(��2Cl2+2Na2CO3 =Cl2O+CO2+2NaCl)
��������
X��Y��Z��J��Q��WΪǰ������Ԫ�أ�ԭ��������������Ԫ��Y�ڵؿ��к�����ߣ�YΪ��Ԫ�أ�W��һ�ֳ������������Ǻ���ɫ��ĩ�����������ᡢͿ�ϡ���ī�ĺ�ɫȾ�ϣ�WΪ��Ԫ�أ������£�����ͼ��25��X��Z��J��Q������������Ӧˮ������Һ(Ũ�Ⱦ�Ϊ0��01mol��L-1)��pH��ԭ�������Ĺ�ϵ��ͼ��ʾ������������Ӧˮ������ҺŨ�Ⱦ�Ϊ0.01molL-1��Z��pHΪ12��ΪһԪǿ���Z��NaԪ�أ�X��Q��pH��Ϊ2��ΪһԪǿ�ᣬ��XΪNԪ�ء�QΪClԪ�أ�J��pHС��2����J��Ϊ��Ԫǿ�ᣬ��JΪSԪ�أ���XΪNԪ�ء�Y ΪOԪ�ء�Z��NaԪ�ء�JΪSԪ�ء�QΪClԪ�ء�WΪFe��
��1������Ԫ�������ɽ��⣬��������Ų���ͬ�����ӣ��˵����Խ�Ժ�����ӵ���������Խǿ���뾶ԼС��
��2���ȽϷǽ�����ʱ��Ҫ�������ڱ���λ�ã��ǽ����Կ��Ը��ݵ��������Ե�ǿ��������������Ӧˮ���������ǿ������̬�⻯����ȶ��Ե��жϣ�
��3��X��J��Q��ЩԪ���γɵĺ���������HNO2��HNO3��H2SO3�� H2SO4��HClO��HClO3�� HClO4�ȡ����������ԭ�ӵļ۲���Ӷ�����ȷ�����ӵ����幹�ͣ�
��4��������D2AΪCl2O������Oԭ�ӹµ��Ӷ������۲���Ӷ������۲���Ӷ���=������Ŀ+�µ��Ӷ���������ȷ���ռ乹�ͣ�������ʪ���Na2CO3��Ӧ�õ�Cl2O���ɵ���ת���غ��֪���ȵõ�HCl���ɣ�HCl����̼���Ʒ�Ӧ��
X��Y��Z��J��Q��WΪǰ������Ԫ�أ�ԭ��������������Ԫ��Y�ڵؿ��к�����ߣ�YΪ��Ԫ�أ�W��һ�ֳ������������Ǻ���ɫ��ĩ�����������ᡢͿ�ϡ���ī�ĺ�ɫȾ�ϣ�WΪ��Ԫ�أ������£�����ͼ��25��X��Z��J��Q������������Ӧˮ������Һ(Ũ�Ⱦ�Ϊ0��01mol��L-1)��pH��ԭ�������Ĺ�ϵ��ͼ��ʾ������������Ӧˮ������ҺŨ�Ⱦ�Ϊ0.01molL-1��Z��pHΪ12��ΪһԪǿ���Z��NaԪ�أ�X��Q��pH��Ϊ2��ΪһԪǿ�ᣬ��XΪNԪ�ء�QΪClԪ�أ�J��pHС��2����J��Ϊ��Ԫǿ�ᣬ��JΪSԪ�أ���XΪNԪ�ء�Y ΪOԪ�ء�Z��NaԪ�ء�JΪSԪ�ء�QΪClԪ�ء�WΪFeԪ�أ�
��1��W����Ԫ�أ�W�����ڱ��е�λ�õ����������� ��Na+ ��O2- ��N3-�ĺ�������Ų���ͬ���˵����Խ���Ԫ�ذ뾶ԽС����Na+ ��O2- ��N3-��
����Na+ ��O2- ��N3-��
��2��O��Sλ��ͬ����Ԫ�أ�ͬ������ϵ��£��ǽ����Լ�������O>S��
A��J���⻯���ˮ��Һ�����ڿ����л����ǣ����ⱻ�������������ʣ�����֤�������������Դ�����A��ȷ��
B��Y��J֮���γɵĻ�������Ԫ�صĻ��ϼۣ������������������ļۣ����Ը����ۣ���֤�����ķǽ�����ǿ����B��ȷ��
C��Y��J�ĵ��ʵ�״̬����ȷ�������Ժͷǽ����ԣ���C����
D��Y��J�����ڱ��е�λ�ã���֪���������һ���ڣ�����λ��ͬһ���壬ͬ����Ԫ�ش��ϵ��£��뾶����ʧ����������ǿ���õ��������������ǽ����Լ�������������ǿ�����Եó����ۣ���D��ȷ��
�ʴ�ѡC��
��3��X��J��Q��ЩԪ���γɵĺ������У����ӵ�����ԭ�ӵļ۲���Ӷ����۲���Ӷ���=������Ŀ+�µ��Ӷ�����
��ЩԪ���ܹ��γɺ������ΪN��S��ClԪ�أ�N��S��Cl��ЩԪ���γɵĺ���������HNO2��HNO3��H2SO3��H2SO4��HClO��HClO3��HClO4�ȡ�
NO2��Nԭ�Ӽ۲���Ӷ�����2+![]() =3����1�Թµ��Ӷԣ�����ΪV�νṹ��
=3����1�Թµ��Ӷԣ�����ΪV�νṹ��
NO3��Nԭ�Ӽ۲���Ӷ�����3+![]() =3�������µ��Ӷԣ�����Ϊƽ�������Σ�
=3�������µ��Ӷԣ�����Ϊƽ�������Σ�
SO32��Sԭ�Ӽ۲���Ӷ�����3+![]() =4����1�Թµ��Ӷԣ�����Ϊ�����Σ�
=4����1�Թµ��Ӷԣ�����Ϊ�����Σ�
SO42��Sԭ�Ӽ۲���Ӷ�����4+![]() =4�������µ��Ӷԣ�����Ϊ�������壬
=4�������µ��Ӷԣ�����Ϊ�������壬
ClO3-��Clԭ�Ӽ۲���Ӷ�����=3+![]() =4����1�Թµ��Ӷԣ�����Ϊ�����Σ�
=4����1�Թµ��Ӷԣ�����Ϊ�����Σ�
����ӵ�����ԭ�ӵļ۲���Ӷ���Ϊ3������HNO2��HNO3������������ṹ������H2SO3��HClO3��
�ʴ�Ϊ��HNO2��HNO3��H2SO3��HClO3��
��4��������D2AΪCl2O��OΪ����ԭ�ӣ��γ�2���������µ��Ӷ���Ϊ![]() =2��������ԭ�ӵļ۲���Ӷ���Ϊ4�����幹��ΪV�Σ�������ʪ���Na2CO3��Ӧ�õ�Cl2O���ɵ���ת���غ��֪���ȵõ�HCl���ɣ�HCl����̼���Ʒ�Ӧ����Ӧ�ķ���ʽΪ��2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl(��2Cl2+2Na2CO3 =Cl2O+CO2+2NaCl)��
=2��������ԭ�ӵļ۲���Ӷ���Ϊ4�����幹��ΪV�Σ�������ʪ���Na2CO3��Ӧ�õ�Cl2O���ɵ���ת���غ��֪���ȵõ�HCl���ɣ�HCl����̼���Ʒ�Ӧ����Ӧ�ķ���ʽΪ��2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl(��2Cl2+2Na2CO3 =Cl2O+CO2+2NaCl)��
�ʴ�Ϊ��V�Σ�2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl(��2Cl2+2Na2CO3 =Cl2O+CO2+2NaCl)��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�