题目内容
19.A、B两种原子,A原子M层比B原子M层少3个电子,B原子L层电子数恰好是A原子L层的两倍,则A元素是( )| A. | O | B. | Si | C. | C | D. | Mg |
分析 B原子的L层电子数恰为A原子L层电子数的2倍,如为同周期元素,则都位于第二周期,不存在M层,可知A为第二周期,B为第三周期,结合电子数的关系可推断元素种类,以此解答该题.
解答 解:B原子的L层电子数恰为A原子L层电子数的2倍,如为同周期元素,则都位于第二周期,不存在M层,可知A为第二周期,B为第三周期,
L层最多排布8个电子,因此,B的L层有8个电子,而A的L层有4个电子(无M层),根据“A原子的M层比B原子的M层少3个电子”可知,B的M层上有3个电子,即A共有K、L电子层,排布的电子数分别为2、4,B共有K、L、M电子层,排布的电子数分别为2、8、3,故A是C,B是Al,
故选C.
点评 本题考查原子结构与元素周期表的关系,为高频考点,答题时要逐步确定A、B的电子层数和各层上的电子数,把排布规律与题意结合起来,整体把握,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.下列金属中,按照金属性从弱到强的顺序排列的是( )
| A. | 铝、镁、钠、钾 | B. | 镁、铝、钾、钠 | C. | 钙、钾、铷、钠 | D. | 钙、钾、钠、锂 |
7.下列各离子组,由于生成沉淀而不能大量共存的是( )
| A. | NH4+、Fe3+、SO42-、SCN- | B. | Na+、Mg2+、NO3-、OH- | ||
| C. | K+、H+、Cl-、OH- | D. | K+、H+、NO3-、CO32- |
4.下列变化过程,属于放热反应的是( )
①液态水变成水蒸气 ②酸碱中和反应③浓H2SO4稀释④固体NaOH溶于水 ⑤H2在Cl2中燃烧 ⑥碳高温条件下还原CO2.
①液态水变成水蒸气 ②酸碱中和反应③浓H2SO4稀释④固体NaOH溶于水 ⑤H2在Cl2中燃烧 ⑥碳高温条件下还原CO2.
| A. | ②③④⑤ | B. | ②③④ | C. | ②⑤ | D. | ①③⑤ |
9.下列有机化合物分子中的所有碳原子不可能处于同一平面的是( )
| A. | HC≡C-CH3 | B. | 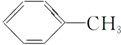 | C. | 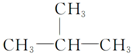 | D. | 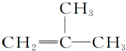 |
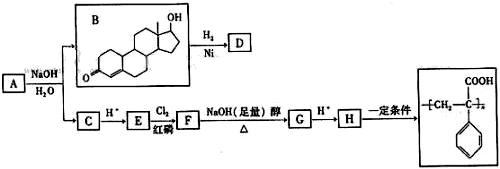
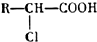 +HCl
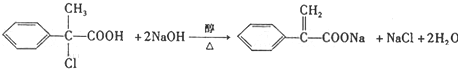
+HCl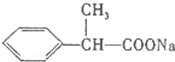
 (其中两种)
(其中两种)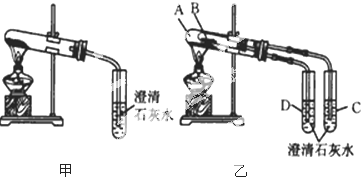
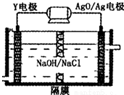 短周期元素X、Y、Z、W原子序数依次增大,X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中,请回答:
短周期元素X、Y、Z、W原子序数依次增大,X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中,请回答: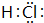 .
.