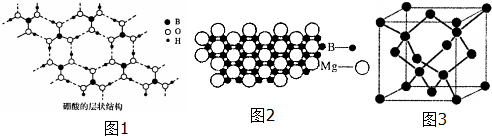
��Ŀ����
8��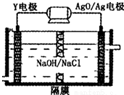 ������Ԫ��X��Y��Z��Wԭ��������������X�⻯���ˮ��Һ�Լ��ԣ�Y��Ԫ�����ڱ���������������������������ȣ�Z�����ǽ�̫����ת��Ϊ���ܵij��ò��ϣ�W����Ҫ�ġ�����Ԫ�ء�����Ҫ�����ε���ʽ�����ں�ˮ�У���ش�
������Ԫ��X��Y��Z��Wԭ��������������X�⻯���ˮ��Һ�Լ��ԣ�Y��Ԫ�����ڱ���������������������������ȣ�Z�����ǽ�̫����ת��Ϊ���ܵij��ò��ϣ�W����Ҫ�ġ�����Ԫ�ء�����Ҫ�����ε���ʽ�����ں�ˮ�У���ش���1��X��Ԫ�����ڱ��е�λ���ǵڶ����ڵ�VA�壻W�⻯��ĵ���ʽ
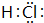 ��
����2��X�⻯���ˮ��Һ��W�⻯���ˮ��Һ��Ϻ�ǡ�÷�Ӧʱ����Һ�����ԣ�������ԡ��������ԡ������ԡ����������ӷ���ʽ��ʾ��ԭ����NH4++H2O?NH3•H2O+H+��
��3��Y-AgO�����Ӧ�ù㷺������أ���ԭ����ͼ��ʾ���õ�صĸ�����ӦʽAl+4OH--3e-=AlO2-+2H2O��
��4����Z��W��ɵĻ�������ˮ����ˮ����������ᣬд�� �˷�Ӧ�Ļ�ѧ����ʽSiCl4+3H2O=H2SiO3��+4HCl��
���� ������Ԫ��X��Y��Z��Wԭ��������������X�⻯���ˮ��Һ�Լ��ԣ���XΪNԪ�أ�Y��Ԫ�����ڱ���������������������������ȣ�ԭ���������ڵ���ֻ�ܴ��ڵ������ڣ���YΪAl��Z�����ǽ�̫����ת��Ϊ���ܵij��ò��ϣ���ZΪSI��W����Ҫ�ġ�����Ԫ�ء�����Ҫ�����ε���ʽ�����ں�ˮ�У�����֪WΪCl���ݴ˽��
��� �⣺������Ԫ��X��Y��Z��Wԭ��������������X�⻯���ˮ��Һ�Լ��ԣ���XΪNԪ�أ�Y��Ԫ�����ڱ���������������������������ȣ�ԭ���������ڵ���ֻ�ܴ��ڵ������ڣ���YΪAl��Z�����ǽ�̫����ת��Ϊ���ܵij��ò��ϣ���ZΪSI��W����Ҫ�ġ�����Ԫ�ء�����Ҫ�����ε���ʽ�����ں�ˮ�У�����֪WΪCl��
��1��XΪNԪ�أ���Ԫ�����ڱ��е�λ���ǣ��ڶ����ڵ�VA�壻W�⻯��ΪHCl������ʽΪ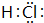 ��
��
�ʴ�Ϊ���ڶ����ڵ�VA�壻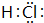 ��
��
��2��������HClǡ�÷�Ӧ����NH4Cl��NH4Cl��Һ�� NH4+����ˮ�⣺NH4++H2O?NH3•H2O+H+���ƻ�ˮ�ĵ���ƽ�⣬��Һ�����ԣ�
�ʴ�Ϊ�����ԣ� NH4++H2O?NH3•H2O+H+��
��3��Al-AgO�����Ӧ�ù㷺������أ�AlΪ����������������Ӧ����������������ƫ��������õ�صĸ�����ӦʽΪ��Al+4OH--3e-=AlO2-+2H2O��
�ʴ�Ϊ��Al+4OH--3e-=AlO2-+2H2O��
��4����Z��W��ɵĻ�����ΪSiCl4����ˮ����ˮ����������ᣬ���ɹ��������ᣬ�˷�Ӧ�Ļ�ѧ����ʽΪ��SiCl4+3H2O=H2SiO3��+4HCl��
�ʴ�Ϊ��SiCl4+3H2O=H2SiO3��+4HCl��
���� ���⿼��ṹ����λ�ù�ϵӦ�ã����ضԻ�ѧ����Ŀ��飬������ѧ���Ի���֪ʶǨ��Ӧ���빮�̣�

| A�� | �������ˮ���Ʊ������ɱ�ϩ��ˮ��Ӧ�Ʊ��� | |
| B�� | �ɼױ������ƶ������ױ����ɼױ������Ʊ����� | |
| C�� | ���ȴ���������ȥ�ƻ���ϩ�����Ҵ�����ϩ | |
| D�� | ��������Ҵ��������������ɱ���������ˮ���Ʊ�������Ҵ� |
| A�� | O | B�� | Si | C�� | C | D�� | Mg |
| A�� | 2s22p4 | B�� | 3s23p4 | C�� | 4s24p4 | D�� | 5s25p4 |

| A�� | �������DZ���ͬϵ�� | B�� | ����̼ԭ�ӿ�����ͬһƽ���� | ||
| C�� | �˷��ӵ�һ��ȡ��������3�� | D�� | �����ʷ���ʽΪC25H22 |
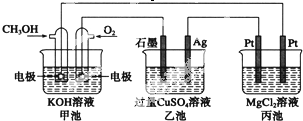
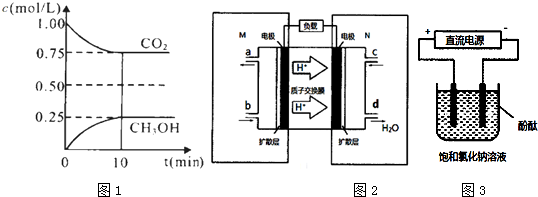
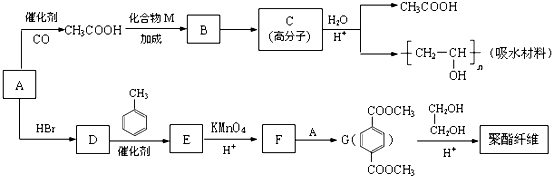
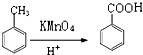
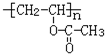 ��D��E�ķ�Ӧ������ȡ����Ӧ��
��D��E�ķ�Ӧ������ȡ����Ӧ��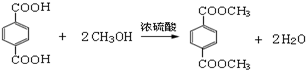 ��
�� ��
�� ��
��