题目内容
解释下列事实的方程式正确的是
A.加热可增强纯碱溶液去污力: |
B.用稀硝酸洗涤做过银镜反应的试管: 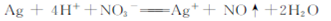 |
C.向煤中加入石灰石可减少煤燃烧时SO2的排放: 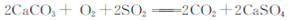 |
| D.碳酸氢钠溶液与少量澄清石灰水混合出现白色沉淀: |
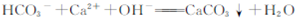
C
解析试题分析: A?碳酸根离子分步水解显碱性,加热促进水解正向进行,溶液碱性增强去污能力强,离子方程式为CO32-+H2O═HCO3-+OH-,故A错误;B?选项中离子方程式电荷不守恒,用稀硝酸洗涤做过银镜反应的试管反应的离子方程式:3Ag+4H++NO3-═3Ag++NO↑++2H2O,故B错误;C?煤中加入石灰石可减少煤燃烧时SO2的排放是碳酸钙分解生成的氧化钙和二氧化硫反应生成亚硫酸钙,在空气中氧化为硫酸钙,反应的化学方程式2CaCO3+O2+2SO2═2CO2+2CaSO4,故C正确;D?酸式盐和碱反应量少的全部反应,离子方程式中符合化学式组成比,碳酸氢钠溶液与少量澄清石灰水混合出现白色沉淀反应的离子方程式:
2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32-,故D错误;故选C.
考点:考查了离子方程式书写方法的相关知识点?

 阅读快车系列答案
阅读快车系列答案无机化合物可根据其组成和性质进行分类:
(1)上述所示的物质分类方法名称是 。
(2)以Na、K、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②、③和⑥后面。(每空填写一个化学式即可)
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①HCl ② | ③ ④Ba(OH)2 | ⑤Na2CO3 ⑥ | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O |
(3)下列10种物质:①水;②空气;③铜丝;④二氧化碳;⑤硫酸;⑥氢氧化钙;⑦氧化钠;⑧Fe(OH)3胶体;⑨碳酸氢钙[Ca(HCO3)2];⑩NH3
属于电解质的是 ____________(填序号,下同); 属于非电解质的是____________。
(4)按要求写出下列反应的离子方程式:
①锌跟稀硫酸反应_______________________________________________________,
②氢氧化钡溶液和稀硫酸反应 ____________________________________________,
③氧化镁滴加稀盐酸____________________________________________________。
下列对各组离子或物质是否能够大量共存解释正确的是 ( )
| A | 常温常压下NH3、O2、H2、CO2 | 不能共存 | NH3为碱性气体,CO2为酸性气体,二者反应生成(NH4)2CO3 |
| B | c(OH-)=1×10-13mol/L溶液中,Fe2+、NO3-、SO42-、Na+ | 不能共存 | 发生反应Fe2++NO3-+4H+=3Fe3++NO+2H2O |
| C | 溶液中: K+、Cu2+、Cl-、NH3?H2O | 不能共存 | 发生反应Cu2++2OH-=Cu(OH)2 |
| D | 溶液中Al3+、Na+、SO42-、HCO3- | 可以共存 | 不能发生反应 |
下列有关叙述中正确的是
| A.难溶于水的电解质一定是弱电解质 |
| B.强电解质在水溶液中的电离过程是不可逆的 |
| C.易溶于水的电解质一定是强电解质 |
| D.强电解质的水溶液导电能力一定比弱电解质水溶液的导电能力强 |
某混合溶液中可能含有下列离子中的若干种:NH4+、Na+、Al3+、Fe2+、Fe3+、AlO2-、SO42-、I-、NO3-、CO32-,已知各离子的浓度均约为0.1mol/L,现取两份20mL该溶液进行如下实验:
(1)第一份加入足量盐酸,产生气体在空气中变为红色,在反应后的溶液中加入BaCl2溶液,有白色沉淀产生。
(2)第二份逐滴滴加NaOH溶液至过量,产生沉淀但不溶解,并有气体逸出。
根据上述实验情况,以下说法错误的是( )。
| A.该混合溶液中一定不含有Fe3+、AlO2-、Al3+、CO32- |
| B.该混合溶液通过继续进行焰色反应可以间接确定是否含有I- |
| C.该混合溶液中肯定含有Fe2+、NH4+、SO42-、NO3- |
| D.向该混合溶液中滴加酚酞试液后呈红色 |
离子方程式H+ + OH-= H2O可表示的化学方程式是( )
| A.盐酸与氢氧化铜的反应 | B.硫酸氢钠与氢氧化钠的反应 |
| C.硫酸与氢氧化镁的反应 | D.盐酸与氨水的反应 |
类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是
| | 已知 | 类推 |
| A. | 将Fe加入CuSO4溶液中 Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中 2Na+Cu2+=Cu+2Na+ |
| B. | 向稀硫酸中加入NaOH溶液至中性 H++OH-=H2O | 向H2SO4溶液中加入Ba(OH)2溶液至中性 H++OH-=H2O |
| C. | 向氯化铝溶液中加入足量NaOH溶液 Al3+ + 4OH- = AlO2- + 2H2O | 向氯化铝溶液中加入足量氨水 Al3+ + 4NH3·H2O = AlO2- + 2H2O +4NH4+ |
| D. | 向Ca(OH)2溶液中通入过量CO2 CO2 + OH- = HCO3- | 向Ca(OH)2溶液中通入过量SO2 SO2 + OH- = HSO3- |