��Ŀ����
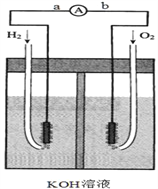
����Ŀ������ȼ�ϵ���Ƿ�����ɫ��ѧ��������ͷ���װ�á���ͼΪ���ʾ��ͼ���õ�ص缫c��d�����һ��ϸС�IJ��ۣ��������������ǿ�������ȶ�����ش�
��1������ȼ�ϵ�ص�����ת����Ҫ��ʽ��______��
��2��������ӦʽΪ______��
��3���õ�ع���ʱ��H2��O2�������ⲿ��������ؿ����������ṩ���ܣ���ˣ�������ȫ�����ǹؼ�����֮һ���������һ����Ҫ�Ĵ�����ϣ�����ͷ���ԭ�����£�
I.2Li+H2 = 2LiH II. LiH +H2O = LiOH + H2��
�ٷ�ӦI�еĻ�ԭ����______����ӦII�е���������______
����֪LiH�����ܶ�Ϊ0.82g/cm3,�������224L(��״��)H2,���ɵ�LiH����뱻���յ�H2�����Ϊ______��
���ɢ����ɵ�LiH��H2O���ã��ų���H2�������ȼ�ϣ�������ת����Ϊ80%��������ͨ�����ӵ����ʵ���Ϊ___________mol��
���𰸡� ��ѧ��ת��Ϊ���� H2-2e-+2OH- = 2H2O Li H2O ![]() 32
32
����������1���õ��ʾ��ͼ�Ƿ�����ɫ��ѧ��������ͷ���װ�ã���������������Ϊȼ�Ͻ���ѧ��ת��Ϊ���ܵ�װ�ã�
��2���õ�صĵ������ҺΪKOH�������������������������������ķ�ӦʽΪ��H2-2e-+2OH- = 2H2O��
��3���ٷ�ӦI��Liת��ΪLi+�����ϼ����ߣ�˵��LiΪ��ԭ������ӦII�У�ˮ����Ļ��ϼ۽��ͣ�ˮ�������������������224L(��״��)H2����10molH2������20molLiH����![]() ������LiH����뱻���յ�H2�����Ϊ
������LiH����뱻���յ�H2�����Ϊ![]() ���۸��ݷ�ӦII�ɵ���LiH~H2~2e-��20mol��LiH������20molH2��ʵ�ʲμӵ�ط�Ӧ������Ϊ16mol�����ͨ�����ߵĵ���Ϊ32mol��
���۸��ݷ�ӦII�ɵ���LiH~H2~2e-��20mol��LiH������20molH2��ʵ�ʲμӵ�ط�Ӧ������Ϊ16mol�����ͨ�����ߵĵ���Ϊ32mol��