题目内容
【题目】草酸亚铁晶体(FeC2O4·2H2O)是一种黄色难溶于水的固体,受热易分解,是生产电池、涂料以及感光材料的原材料。为探究纯净草酸亚铁晶体热分解的产物,设计装置图如图:
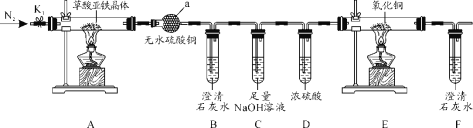
(1)仪器a的名称是___。
(2)从绿色化学考虑,该套装置存在的明显缺陷是___。
(3)向盛有草酸亚铁晶体的试管中滴入硫酸酸化的KMnO4溶液,振荡,溶液变为棕黄色,同时有气体生成。已知反应中MnO![]() 转化为无色的Mn2+,则该过程中被氧化的元素是___。若反应中消耗lmolFeC2O4·2H2O,则参加反应的n(KMnO4)=___。
转化为无色的Mn2+,则该过程中被氧化的元素是___。若反应中消耗lmolFeC2O4·2H2O,则参加反应的n(KMnO4)=___。
(4)草酸亚铁晶体在空气易被氧化,检验草酸亚铁晶体是否氧化变质的实验试剂是___。
(5)称取5.40g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体质量随温度变化的曲线如图所示:
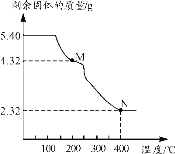
①图中M点对应物质的化学式为___。
②已知400℃时,剩余固体是铁的一种氧化物,试通过计算写出该化合物与稀盐酸反应的离子方程式:___。
【答案】球形干燥管(干燥管) 缺少处理CO尾气装置 Fe和C ![]() mol 取少量草酸亚铁晶体于试管中,加入稀硫酸溶解后并滴加KSCN溶液,若溶液变红色,则草酸亚铁晶体已氧化变质;若不变红色,则草酸亚铁晶体未氧化变质 FeC2O4 Fe3O4+8H+=Fe2++2Fe3++4H2O
mol 取少量草酸亚铁晶体于试管中,加入稀硫酸溶解后并滴加KSCN溶液,若溶液变红色,则草酸亚铁晶体已氧化变质;若不变红色,则草酸亚铁晶体未氧化变质 FeC2O4 Fe3O4+8H+=Fe2++2Fe3++4H2O
【解析】
装置A为草酸亚铁晶体分解,利用无水硫酸铜检验水蒸气,B装置检验二氧化碳,C装置吸收二氧化碳,D装置干燥气体,E装置检验CO,F装置检验二氧化碳,据此解答。
(1)仪器a的名称是球形干燥管(干燥管),故答案为:球形干燥管(干燥管);
(2)反应会产生CO,缺少处理CO尾气装置,故答案为:缺少处理CO尾气装置;
(3) 高锰酸钾溶液的紫红色褪去,溶液变为棕黄色,同时有气体生成,很显然是FeC2O4被高锰酸钾氧化为Fe3+使溶液变为棕黄色,同时生成二氧化碳气体,则该过程中被氧化的元素是Fe和C;分析有关元素化合价的变化可知,反应过程中1 mol FeC2O4·2H2O可失去3 mol电子,而l mol KMnO4可得到5 mol电子:根据得失电子数相等的原则,反应中FeC2O4·2H2O与KMnO4的物质的量之比为5:3。因此,若反应中消耗1 mol FeC2O4·2H2O,则参加反应的KMnO4为![]() mol;
mol;
(4)检验铁离子的试剂为KSCN,具体有:取少量草酸亚铁晶体于试管中,加入稀硫酸溶解后并滴加KSCN溶液,若溶液变红色,则草酸亚铁晶体已氧化变质;若不变红色,则草酸亚铁晶体未氧化变质;
(5)①草酸亚铁晶体的物质的量为:![]() =0.03mol,通过剩余固体的质量为4.32g,则M的摩尔质量为
=0.03mol,通过剩余固体的质量为4.32g,则M的摩尔质量为![]() =144g/mol,FeC2O4的相对分子质量为144,所以开始发生的反应是:草酸亚铁晶体受热失去结晶水,剩下的M为FeC2O4,故答案为:FeC2O4;
=144g/mol,FeC2O4的相对分子质量为144,所以开始发生的反应是:草酸亚铁晶体受热失去结晶水,剩下的M为FeC2O4,故答案为:FeC2O4;
②草酸亚铁晶体中的铁元素质量为:![]() =1.68g,草酸亚铁晶体中的铁元素完全转化到氧化物中,氧化物中氧元素的质量为:
=1.68g,草酸亚铁晶体中的铁元素完全转化到氧化物中,氧化物中氧元素的质量为:![]() ,设铁的氧化物的化学式为FexOy,则有:
,设铁的氧化物的化学式为FexOy,则有:![]() ,解得x:y=3:4,铁的氧化物的化学式为Fe3O4,因此Fe3O4与稀盐酸反应的离子方程式为:Fe3O4+8H+=Fe2++2Fe3++4H2O。
,解得x:y=3:4,铁的氧化物的化学式为Fe3O4,因此Fe3O4与稀盐酸反应的离子方程式为:Fe3O4+8H+=Fe2++2Fe3++4H2O。

 轻松课堂单元期中期末专题冲刺100分系列答案
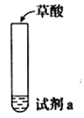
轻松课堂单元期中期末专题冲刺100分系列答案【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:H2C2O4是弱电解质)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是( )
A.H2C2O4有酸性:Ca(OH)2+ H2C2O4=CaC2O4↓+2H2O
B.酸性H2C2O4> H2CO3:NaHCO3+ H2C2O4=NaHC2O4+CO2↑+H2O
C.H2C2O4具有还原性:2![]() +5
+5![]() +16H+=2Mn2++10CO2↑+ 8H2O
+16H+=2Mn2++10CO2↑+ 8H2O
D.H2C2O4可发生酯化反应:HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O