题目内容
阴离子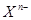 含中子N个,X的质量数为A,a g X的氢化物中含质子的物质的量是( )
含中子N个,X的质量数为A,a g X的氢化物中含质子的物质的量是( )
A.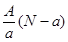 mol mol | B.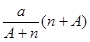 mol mol |
C.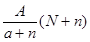 mol mol | D. mol mol |
D
解析试题分析:根据题意知,阴离子Xn-含中子N个,X的质量数为A,则X的质子数为A-N;由阴离子Xn-知X的氢化物化学式为HnX,则1个HnX分子中含有的质子数为A-N+n,氢化物HnX的摩尔质量为(A+n)g/mol,agX的氢化物中含质子的物质的量为 mol,选D。
mol,选D。
考点:考查原子的构成,中子数、质子数、质量数之间的关系。

有a、b、c、d四种金属,将a与b用导线连结起来浸入稀硫酸溶液中,b不被腐蚀。将a、d分别投入等浓度的盐酸中,d比a反应剧烈;将Cu浸入b的盐溶液里,无明显变化。如果把Cu浸入c的盐溶液里,有c的单质析出。据此判断它们的活动性由强到弱的顺序是( )
| A.d>c>a>b | B.d>b>a>c | C.b>a>d>c | D.d>a>b>c |
下列叙述中错误的是 ( )
| A.原子半径:Cl>S>O | B.还原性:Na>Mg>Al |
| C.稳定性:HF>HCl>HBr | D.酸性:HClO4>H2SO4>H3PO4 |
下列说法不符合ⅦA族元素性质特征的是
| A.易形成-1价离子 | B.从上到下原子半径逐渐减小 |
| C.从上到下非金属性逐渐减弱 | D.从上到下氢化物的稳定性依次减弱 |
下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )[来源&:中*^教@#网]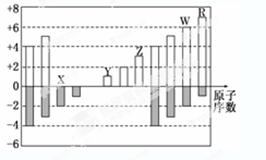
| A.原子半径:Z>Y>X |
| B.气态氢化物的稳定性:W>R |
| C.WX3和水反应形成的化合物是离子化合物[来*源#^@:中国教育出版~网] |
| D.Y和Z两者最高价氧化物对应的水化物能相互反应 |
下列有关原子结构和元素周期律的表述正确的是 ( )
①原子序数为15的元素的最高化合价为+3 ②ⅦA族元素是同周期中非金属性最强的元素 ③第二周期ⅣA族元素的原子核电荷数和中子数一定为6 ④原子序数为12的元素位于元素周期表的第三周期ⅡA族
| A.①② | B.①③ | C.②④ | D.③④ |
下列递变情况中不正确的是
| A.HF、HCl、HBr、HI的沸点依次升高 |
| B.硅、磷、硫、氯元素的最高正化合价依次升高 |
| C.O2-、F-、Na+、Mg2+的离子半径依次增大 |
| D.锂、钠、钾、铷的金属性依次增强 |
现有短周期主族元素X、Y、Z、R、T。R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡。六种元素的原子半径与原子序数的关系如图所示。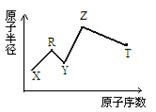
下列推断正确的是
| A.离子半径:Y<Z |
| B.氢化物的沸点和稳定性排序 :R<Y |
| C.最高价氧化物对应的水化物的酸性 :T> R |
| D.由X、R、Y、Z四种元素组成的化合物水溶液一定显酸性 |
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2一具有相同的电子层结构,离子半径:Z2->W一;Y的内层电子总数是最外层电子数的5倍。下列说法中不正确的是 ( )
| A.W、M的某种单质可作为水处理中的消毒剂 |
| B.电解YW2的熔融物可制得Y和W的单质 |
| C.相同条件下,w的氢化物水溶液酸性比Z弱 |
| D.X、M两种元素形成的一种化合物与水反应可生成M的某种单质 |