题目内容
现有短周期主族元素X、Y、Z、R、T。R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡。六种元素的原子半径与原子序数的关系如图所示。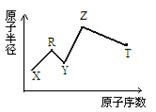
下列推断正确的是
| A.离子半径:Y<Z |
| B.氢化物的沸点和稳定性排序 :R<Y |
| C.最高价氧化物对应的水化物的酸性 :T> R |
| D.由X、R、Y、Z四种元素组成的化合物水溶液一定显酸性 |
BC
解析试题分析:首先审题“短周期主族元素”为1-18号元素;“最外层电子数是电子层数的2倍”可知R是C或S;“Z2Y、Z2Y2型离子化合物”根据高中的内容,应是Na2O、Na2O2,即Z为Na,Y为O, “Z2T 化合物能破坏水的电离平衡”,结合Z为Na及T为-2价可知T为S,而R则为C,所以Y为O、Z为Na、R为C、T为S,由坐标图可知X的半径及原子序数最比C小,只能是H。
A.O2-﹥Na+,错误;B.氢化物CH4﹤H2O,正确;C.酸性H2SO4﹥H2CO3,正确;D.H、O、Na、C 组成的化合物也可以显碱性,如NaHCO3,错误。
考点:短周期元素,原子结构,Na、S、C、O、H等元素及化合物的性质,氢化物的稳定性判断、半径大小比较,离子化合物与共价化合物的区别、最高价氧化物对应水化物酸性强弱的比较。

 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案短周期元素X、Y、Z在元素周期表中的位置下图所示,下列说法正确的是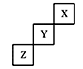
| A.X、Y、Z三种元素中,单质在常温下均为气态 |
| B.Z的氢化物的稳定性比Y的强 |
| C.Y的最高正化合价为+5 |
| D.Y的单质的熔点比Z的低 |
阴离子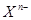 含中子N个,X的质量数为A,a g X的氢化物中含质子的物质的量是( )
含中子N个,X的质量数为A,a g X的氢化物中含质子的物质的量是( )
A.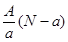 mol mol | B.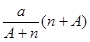 mol mol |
C.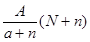 mol mol | D. mol mol |
3He月球上储量丰富,4He则来源于宇宙射线的初级粒子。下列关于3He和4He的说法正确的是
| A.两者互为同位素 | B.两者互为同素异形体 |
| C.两者为同一种原子 | D.两者具有相同的中子数 |
有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是
| A.若X(OH)n为强碱,则Y(OH)n也一定为强碱 |
| B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性 |
| C.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2 |
| D.若Y的最高正价为+m,则X的最高正价一定为+m |
X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构。下列说法正确的是
| A.Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点 |
| B.原子半径:Z>Y>X |
| C.CaY2与水发生氧化还原反应时,CaY2只作氧化剂 |
| D.CaY2和CaZ22种化合物中,阳离子与阴离子个数比均为1︰2 |
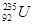 是重要的核工业原料,但在自然界的丰度很低,
是重要的核工业原料,但在自然界的丰度很低,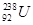 互为同位素
互为同位素