题目内容
下列递变情况中不正确的是
| A.HF、HCl、HBr、HI的沸点依次升高 |
| B.硅、磷、硫、氯元素的最高正化合价依次升高 |
| C.O2-、F-、Na+、Mg2+的离子半径依次增大 |
| D.锂、钠、钾、铷的金属性依次增强 |
AC
解析试题分析:A、HF分子间存在氢键,所以沸点是卤族元素氢化物中最高的,错误;B、同周期元素,最高正价一般从左到右逐渐升高,正确;C、这4种离子的电子层结构相同,核电荷数越少离子半径越大,所以O2-、F-、Na+、Mg2+的离子半径依次减小,错误;D、碱金属元素从上到下元素的金属性逐渐增强,正确,答案选AC。
考点:考查物质沸点的比较,化合价、离子半径、金属性的变化规律

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素( )
| A.在自然界中只以化合态的形式存在 |
| B.单质常用作半导体材料和光导纤维 |
| C.最高价氧化物不与酸反应 |
| D.气态氢化物比甲烷稳定 |
阴离子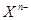 含中子N个,X的质量数为A,a g X的氢化物中含质子的物质的量是( )
含中子N个,X的质量数为A,a g X的氢化物中含质子的物质的量是( )
A.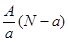 mol mol | B.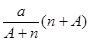 mol mol |
C.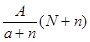 mol mol | D.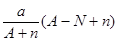 mol mol |
已知X、Y、Z为三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对强弱是:HXO4>H2YO4>H3ZO4。则下列说法正确的是
| A.气态氢化物的稳定性:HX>H2Y>ZH3 | B.非金属性:Y<X<Z |
| C.原子半径:X>Y>Z | D.原子序数:Z>Y>X |
3He月球上储量丰富,4He则来源于宇宙射线的初级粒子。下列关于3He和4He的说法正确的是
| A.两者互为同位素 | B.两者互为同素异形体 |
| C.两者为同一种原子 | D.两者具有相同的中子数 |
下列叙述中错误的是 ( )
| A.原子半径:Cl>S>O | B.还原性:Na>Mg>Al |
| C.稳定性:HF>HCl>HBr | D.酸性:HClO4>H2SO4>H3PO4 |
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是( )
| A.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) |
| B.Y分别与Z、W形成的化合物中化学键类型相同 |
| C.X的最高价氧化物对应水化物的酸性比W的弱 |
| D.Y的气态简单氢化物的热稳定性比W的强 |