题目内容
有a、b、c、d四种金属,将a与b用导线连结起来浸入稀硫酸溶液中,b不被腐蚀。将a、d分别投入等浓度的盐酸中,d比a反应剧烈;将Cu浸入b的盐溶液里,无明显变化。如果把Cu浸入c的盐溶液里,有c的单质析出。据此判断它们的活动性由强到弱的顺序是( )
| A.d>c>a>b | B.d>b>a>c | C.b>a>d>c | D.d>a>b>c |
D
解析试题分析:将a与b用导线连结起来浸入稀硫酸溶液中,b不被腐蚀。则活动性a>b;将a、d分别投入等浓度的盐酸中,d比a反应剧烈;则金属活动性d>a;将Cu浸入b的盐溶液里,无明显变化。则活动性b>Cu;如果把Cu浸入c的盐溶液里,有c的单质析出。则活动性Cu >c;所以金属活动性:d>a>b>c 。故选项是D。
考点:考查金属活动性的比较的知识。

有关叙述:能说明M比N的非金属性强的叙述是
①非金属单质M能从N的化合物中置换出非金属单质N。
②M原子比N原子容易得到电子。
③单质M跟H2反应比N跟H2反应容易得多。
④气态氢化物水溶液的酸性HmM>HnN。
⑤最高价氧化物对应水化物的酸性HmMOx>HnNOy。
⑥熔点M>N。
| A.①②③⑤ | B.②⑤ |
| C.①②③④⑤ | D.全部 |
下列说法中正确的是
| A.只含有非金属元素的化合物可能是离子化合物 |
| B.第ⅠA族元素都比第ⅡA族元素金属性强 |
| C.只含有共价键的物质一定是共价化合物 |
| D.同主族元素原子半径越小越容易失去电子 |
元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是
| A.同周期元素中X的金属性最强 |
| B.同周期元素中Y的最高价含氧酸的酸性最强 |
| C.原子半径X>Y,离子半径X+>Z2- |
| D.同族元素中Z的氢化物稳定性最高 |
短周期元素X、Y、Z在元素周期表中的位置下图所示,下列说法正确的是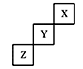
| A.X、Y、Z三种元素中,单质在常温下均为气态 |
| B.Z的氢化物的稳定性比Y的强 |
| C.Y的最高正化合价为+5 |
| D.Y的单质的熔点比Z的低 |
阴离子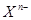 含中子N个,X的质量数为A,a g X的氢化物中含质子的物质的量是( )
含中子N个,X的质量数为A,a g X的氢化物中含质子的物质的量是( )
A.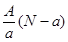 mol mol | B.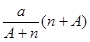 mol mol |
C.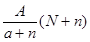 mol mol | D. mol mol |
下列顺序表述正确的是
| A.酸性:H3PO4> HNO3> HClO4 | B.稳定性:H2O > HF > H2S |
| C.原子半径:Na > Mg > O | D.还原性:F-> Cl-> S2- |
天然存在的金属钫(Fr)极微量。它的21种已知同位素都有放射性。它是碱金属元素中最重的元素。根据它在周期表中的位置预言其性质,其中不正确的是( )
| A.在空气中燃烧时生成氧化物Fr2O | B.在已知元素中具有最大的原子半径 |
| C.氧化物对应的水化物碱性极强 | D.其单质的熔点比金属钠的熔点低 |
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是( )
| A.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) |
| B.Y分别与Z、W形成的化合物中化学键类型相同 |
| C.X的最高价氧化物对应水化物的酸性比W的弱 |
| D.Y的气态简单氢化物的热稳定性比W的强 |