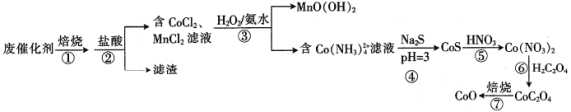
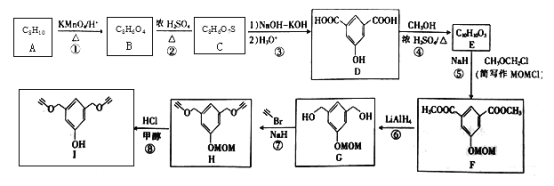
题目内容
【题目】甲醇是重要的化工原料,又是一种可再生能源,具有广泛的开发和应用前景。
(1)已知反应CO(g)+2H2(g)![]() CH3OH(g) H=-99kJmol-1中的相关化学键键能如下:
CH3OH(g) H=-99kJmol-1中的相关化学键键能如下:
则x=___________。
化学键 | H-H | C-O | C三O | H-O | C-H |
E/(kJmol-1) | 436 | 343 | x | 465 | 413 |
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)![]() CH3OH(g) H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如下图所示。
CH3OH(g) H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如下图所示。
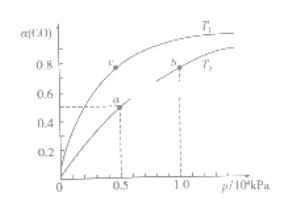
①T1_________T2(填“>”、“<”、“=”);a、b两点的反应速率:v(a)_____v(b)(填“>”、“<”、“=”);
在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是_____(填字母);
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
C.混合气体的密度不再改变 d.CO和CH3OH的物质的量之和保持不变
②计算图中a点的平衡常数KP=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生的主要反应如下:
a:CO(g)+2H2(g)![]() CH3OH(g) H1
CH3OH(g) H1
b:CO2(g)+H2(g)![]() CO(g)+H2O(g) H2
CO(g)+H2O(g) H2
c:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) H3
CH3OH(g)+H2O(g) H3
①述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如下图所示。
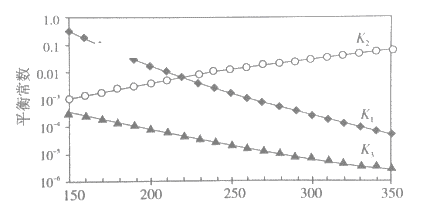
则H1__________H3(填“>”、“<”、“=”),理由是_______。
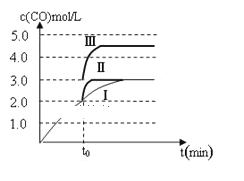
②一定温度下,在3 L容积可变的密闭容器中发生反应b,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是________;当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_________。
③反应c的 △H___0, △S____0(填“>”“=”或“<”)。
【答案】1076<<bc1.6×10-7 (kPa)-2<由图可知,随着温度升高,K2增大,则△H2>0,根据盖斯定律又得△H3=△H1+△H2,所以△H1<△H3加入催化剂将容器的体积快速压缩至2L<<
【解析】
(1)根据反应热=反应物的总键能-生成物的总键能计算;
(2)①压强相同时一氧化碳的转化率高,所以平衡正向移动,而正反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故T1<T2;压强越大反应速率越快,所以a、b两点的反应速率:v(a)<v(b);根据化学平衡时正逆反应速率相等,各物质含量不再改变分析;
②结合化学平衡三行计算列式计算平衡物质的物质的量,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;
(3) ①反应1、2、3其对应的平衡常数分别为K1、K2、K3,根据图1它们随温度变化的曲线结合盖斯定律进行分析解答。
②图象分析曲线Ⅰ变化为曲线Ⅱ是缩短反应达到平衡的时间,最后达到相同平衡状态,体积是可变得是恒压容器,说明改变的是加入了催化剂;当曲线Ⅰ变为曲线Ⅲ时一氧化碳物质的量增大,反应是气体体积不变的反应,可变容器中气体体积和浓度成反比,气体物质的量不变;
③由图可知,随着温度升高,K3减小,则△H3<0,根据反应物和产物气体系数和的大小可以判断熵变符号。
(1)反应热=反应物的总键能-生成物的总键能,则△H =2×436+x-343-413×3-465=-99,计算得出x=1076;
因此,本题正确答案是:1076;
(2)①压强相同时一氧化碳的转化率高,所以平衡正向移动,而正反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故T1<T2;压强越大反应速率越快,所以a、b两点的反应速率:v(a)<v(b);
a.H2的消耗速率是CH3OH生成速率的2倍均为正反应速率,不能说正逆反应速率相等,故a错误;
b.CH3OH的体积分数随着反应的进行增大,不再改变时化学平衡,故b正确;
c.混合气体的总质量不变,容器可变,则混合气体的体积减小,密度增大,不再改变时化学平衡,故c正确;
d.CO和CH3OH的物质的量之和保持不变,不能说明化学平衡,故d错误;
因此,本题正确答案是:< ;<;bc
②a点的一氧化碳转化率为50%,总压为0.5![]() 104pa,
104pa,
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始量(mol) 1 2 0
变化量(mol) x 2x x
平衡量(mol) 1-x 2-2x x
而一氧化碳转化率为50%,所以x=0.5,Kp= =1.6×10-7 (kPa)-2;
=1.6×10-7 (kPa)-2;
因此,本题正确答案是:1.6×10-7 (kPa)-2;
(3) ①由图可以知道,随着温度升高,K2减小,则△H2>0,根据盖斯定律又得△H3=△H1+△H2,所以△H1<△H3 ;
因此,本题正确答案是:< ;由图可知,随着温度升高,K2增大,则△H2>0,根据盖斯定律又得△H3=△H1+△H2,所以△H1<△H3;
②图象分析曲线Ⅰ变化为曲线Ⅱ是缩短反应达到平衡的时间,最后达到相同平衡状态,体积是可变得是恒压容器,说明改变的是加入了催化剂;当曲线Ⅰ变为曲线Ⅲ时一氧化碳物质的量增大反应是气体体积不变的反应,可变容器中气体体积和浓度成反比,气体物质的量不变,曲线Ⅰ,体积为3L,一氧化碳浓度为3mol/L,改变条件不好为曲线Ⅱ,一氧化碳浓度为4.5mol/L,则体积压缩体积为:3:V=4.5:3,V=2L,所以将容器的体积快速压缩至2L符合;
因此,本题正确答案是:加入催化剂;将容器的体积快速压缩至2L;
③由图可知,随着温度升高,K3减小,则△H3<0;该反应中,反应物的系数和大于产物气体系数和,所以该反应是熵减的反应,熵变小于零,
因此,本题正确答案是:<;<。