题目内容
【题目】某100mL溶液可能含有Na+、NH4+、Fe2+、CO32、SO42、Cl中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )

A. 向原溶液中加K3Fe(CN)6溶液,无明显现象
B. 原溶液中c(Cl-)≥0.1mol˙L-1
C. 用洁净的铂丝蘸取原溶液,在酒精灯上灼烧,火焰呈黄色
D. 将湿润的红色石蕊试纸靠近实验产生的气体,试纸变蓝
【答案】C
【解析】
根据流程分析可知:100mL溶液加入氯化钡溶液产生的沉淀1为4.30g,加入盐酸后,沉淀2质量变为2.33g,说明原溶液中含有:CO32、SO42;滤液加入氢氧化钠溶液,产生气体氨气,原溶液中含有NH4+;所以原溶液中一定含有CO32、SO42、NH4+,一定不含Fe2+;
A. 综合上述分析可知,原溶液中一定不含Fe2+,向原溶液中加K3Fe(CN)6溶液,无明显现象,A正确;
B. 硫酸钡沉淀2.33g,n(SO42)= n(BaSO4)=2.33/233=0.01mol, n(CO32)= n(BaCO3)=(4.30-2.33)/197=0.01mol,n(NH4+)= n(NH3)=1.12/22.4=0.05mol,根据电荷守恒可知,0.01×2+0.01×2<0.05×1,所以溶液中含有Cl;如果溶液中还含有阳离子Na+,则原溶液中c(Cl-)≥0.1mol˙L-1,B正确;
C. 根据(B)分析可知,溶液中不一定含Na+,C错误;
D. 通过以上分析可知,溶液中含有NH4+,加入强碱后加热,产生的气体能够将湿润的红色石蕊试纸试纸变蓝,该气体为氨气,D正确;
正确选项C。

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案【题目】已知几种元素的性质或原子结构的相关叙述如表所示。
元素 | 元素性质或原子结构的相关叙述 |
T | 失去1个电子后,形成与Ne相同的核外电子排布 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 其某种单质是空气的主要成分,也是最常见的助燃剂 |
Z | 原子核外有3个电子层,最外层比次外层少1个电子 |
回答下列问题:
(1)写出工业上用X的单质来制备粗硅的化学方程式_________________________。
(2)Y形成的另一种单质主要存在于地球的平流层中,被称作地球生物的保护伞,该单质的化学式是________。
(3)元素Z在海水中含量非常高,海水中含Z元素的化合物主要是__________(写化学式)。
(4)画出T原子的结构示意图:____________。
(5)T元素组成的单质在Y元素组成的常见单质中燃烧,得到的产物的化学式是________,电子式是____________。
【题目】铬是重要的战略物质之一,由于具有质硬,耐磨,耐高温,抗腐蚀性等特性,所以在工业上应用比较广泛,在冶金工业上主要用铬铁矿(Cr2O3 、FeO、SiO2 、Al2O3 等,其它杂质不参加反应)生产铬和铁等金属。流程如下:
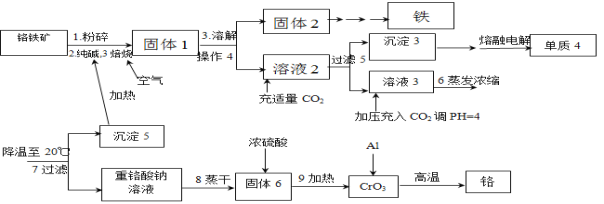
已知:2Cr2O3+3O2+4Na2CO3![]() 4Na2CrO4+4CO2;部分物质的溶解度(单位g)
4Na2CrO4+4CO2;部分物质的溶解度(单位g)
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | |
Na2CO3 | 7.0 | 13 | 29 | 40 | 49 | 46 | 44 |
NaHCO3 | 6.9 | 8.5 | 9.6 | 11.1 | 12.7 | 14.4 | 16.9 |
Na2Cr2O7 | 161 | 170 | 183 | 198 | 218 | 240 | 265 |
(1)粉碎的目的
(2)写出焙烧时含铝物质发生的化学反应方程式_______________________________;
(3)操作4是_______________________,沉淀3含有的物质有_____________________;
(4)写出生成沉淀5的离子方程式_____________________________________________;
(5)整个流程可以循环使用的物质有___________________________;
(6)最后一步制备金属铬的化学方程式______________________________。