题目内容
向含0.2molAlCl3的溶液中加入了一定量的1mol/L的NaOH溶液后,生成了7.8克的沉淀,则加入的NaOH溶液的体积为:
| A.100ml | B.200ml | C.300ml | D.400ml |
C
析:0.2molAlCl3的溶液中加入了一定量的1mol/L的NaOH溶液后,可能发生Al3++3OH-=Al(OH)3↓,
Al(OH)3+OH-=AlO2-+2H2O,根据AlCl3的物质的量和沉淀的物质的量进行计算.
解答:解:n(Al(OH)3)=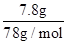 =0.1mol,而AlCl3的物质的量为0.2mol,则说明AlCl3并没有全部生成沉淀,可能有两种情况:
=0.1mol,而AlCl3的物质的量为0.2mol,则说明AlCl3并没有全部生成沉淀,可能有两种情况:
(1)NaOH不足:
Al3++3OH-=Al(OH)3↓
3mol 1mol
n 0.1mol
n=0.3mol,V(NaOH)=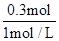 =0.3L=300ml;
=0.3L=300ml;
(2)NaOH过量
Al3++3OH-=Al(OH)3↓
1mol 3mol 1mol
0.2mol 0.6mol 0.2mol
Al(OH)3+OH-=AlO2-+2H2O
0.1mol 0.1mol
共需n(NaOH)=0.6mol+0.1mol=0.7mol
V(NaOH)=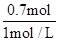 =0.7L=700ml,
=0.7L=700ml,
所以加入的NaOH溶液的体积可能为300ml或700ml,
故选C.
Al(OH)3+OH-=AlO2-+2H2O,根据AlCl3的物质的量和沉淀的物质的量进行计算.
解答:解:n(Al(OH)3)=
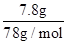 =0.1mol,而AlCl3的物质的量为0.2mol,则说明AlCl3并没有全部生成沉淀,可能有两种情况:
=0.1mol,而AlCl3的物质的量为0.2mol,则说明AlCl3并没有全部生成沉淀,可能有两种情况:(1)NaOH不足:
Al3++3OH-=Al(OH)3↓
3mol 1mol
n 0.1mol
n=0.3mol,V(NaOH)=
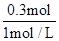 =0.3L=300ml;
=0.3L=300ml;(2)NaOH过量
Al3++3OH-=Al(OH)3↓
1mol 3mol 1mol
0.2mol 0.6mol 0.2mol
Al(OH)3+OH-=AlO2-+2H2O
0.1mol 0.1mol
共需n(NaOH)=0.6mol+0.1mol=0.7mol
V(NaOH)=
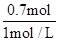 =0.7L=700ml,
=0.7L=700ml,所以加入的NaOH溶液的体积可能为300ml或700ml,
故选C.

练习册系列答案
相关题目

 A、B两种盐可发生下列变化,且B的焰色反应呈黄色(图中其它生成物未列出)
A、B两种盐可发生下列变化,且B的焰色反应呈黄色(图中其它生成物未列出)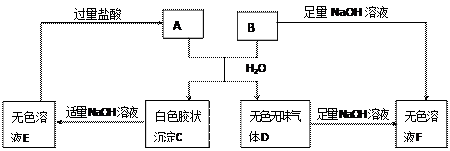
 Cl反应,另一份与过量NaOH溶液反应,产生的H2体积比为1:2,则两份铝屑的质量比为
Cl反应,另一份与过量NaOH溶液反应,产生的H2体积比为1:2,则两份铝屑的质量比为