题目内容
【题目】已知:A、B、C、D、E五种元素,原子序数依次增大。A是短周期中原子半径最大的元素,B元素3p能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素;E的原子序数比D大3。试回答下列有关的问题:
(1)写出D元素价电子的电子排布图:______________。
(2)D可形成化合物[D(H2O)6](NO3)3 ,[D(H2O)6](NO3)3中阴离子的立体构型是____________。NO2-中心原子的轨道杂化类型为______________,1 mol [D(H2O)6] 3+ 中含有的σ键数为 ______________。
(3)已知B、C两种元素形成的化合物通常有两种。这两种化合物中___________ (填化学式)为非极性分子。另一种物质的电子式为 ______________。
(4)D是一种硬而脆抗腐蚀性强的金属,常用于电镀和制造特种钢。下图为D的晶胞结构图,则D晶胞属于___________堆积;该晶胞中原子的体积占晶胞体积的百分率为___________。(已知:π=3.14,![]() =1.732)
=1.732)

(5)E晶体的一种晶胞(如图所示)的边长为anm,密度为ρg·cm-3,NA表示阿伏加德罗常数的值,则E的原子半径为___________nm,E的相对原子质量可表示为___________。

【答案】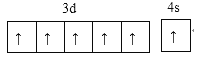 平面三角形 sp2杂化 18NA PCl5
平面三角形 sp2杂化 18NA PCl5 ![]() 体心立方 68
体心立方 68 ![]() a 5a3ρNA×10-22
a 5a3ρNA×10-22
【解析】
A、B、C、D四种元素,原子序数依次增大。A是短周期中原子半径最大的元素为Na元素,B元素3p能级半充满为P元素,C是所在周期电负性最大的元素为Cl元素,D是第四周期未成对电子最多的元素为Cr元素,
(1)D元素为铬元素,能层上为半充满状态时价电子为未成对电子最多;
(2)①依据价电子互斥理论确定硝酸根离子的空间构型,再结合杂化轨道理论判断其中心原子的杂化类型;
②结合物质结构判断含有σ键数;
(3)B、C两种元素分别为P和Cl,形成化合物为:PCl3,PCl5,结构对称的正负电荷重心重合的为非极性分子,结合共价键电子式书写方法解答;
(4)依据金属晶体中金属原子在空间上的堆积模型分析判断;原子的体积占晶胞体积的百分率即空间利用率,结合晶胞结构进行计算;
(5)利用均摊法计算晶胞内原子的个数,再结合晶体的密度 = 晶胞的密度= ![]() 推导出晶体的摩尔质量,其数值即为所求。
推导出晶体的摩尔质量,其数值即为所求。
(1)D元素为铬元素,能层上为半充满状态时价电子为未成对电子最多,其价电子的电子排布图为 ,
,
故答案为: ;
;
(2)①硝酸根离子中价电子对个数=3+![]() (5+1-3×2)=3,且不含孤对电子,所以该分子为平面三角形,中心原子采用sp2杂化;
(5+1-3×2)=3,且不含孤对电子,所以该分子为平面三角形,中心原子采用sp2杂化;
故答案为:平面三角形;sp2杂化;
②在 [D(H2O)6] 3+中配合离子Cr3+与水之间形成的化学键为配位键,配位键是特殊的共价键,属于σ键,所以1 mol [D(H2O)6] 3+中含有σ键有12+6 = 18 mol = 18 NA;
故答案为:18 NA;
(3)B、C两种元素分别为P和Cl,形成化合物为:PCl3,PCl5,其中PCl3为三角锥性结构,属于极性分子,PCl5为三角双锥性结构,属于非极性分子,PCl3电子式为:![]() ;
;
故答案为:PCl5;![]() ;
;
(4)由晶胞结构图可知,该金属原子的晶胞堆积模型为体心立方堆积模型,根据均摊法可知晶胞内所含原子数 = 8×![]() +1= 2,设该晶胞的边长为a cm,原子为等径圆球,其半径为r cm,则结合几何构型可知,等径圆球的半径为该晶胞体对角线的1/4,即a =
+1= 2,设该晶胞的边长为a cm,原子为等径圆球,其半径为r cm,则结合几何构型可知,等径圆球的半径为该晶胞体对角线的1/4,即a = ![]() ,则该晶胞中原子的体积占晶胞体积的百分率为
,则该晶胞中原子的体积占晶胞体积的百分率为![]() =
= ![]() =
= ![]() ×100% =
×100% = ![]() ×3.14×100%
×3.14×100%![]() 68%,
68%,
故答案为:体心立方;68;
(5)E的原子序数比D大3,则E为钴元素,结合E晶体的一种晶胞模型根据均摊法可知晶胞内所含原子数 = 8×![]() +1= 2,则结合几何构型可知,E的原子半径为该晶胞体对角线的1/4 =
+1= 2,则结合几何构型可知,E的原子半径为该晶胞体对角线的1/4 = ![]() a,则该晶胞的质量为
a,则该晶胞的质量为![]() g = ρ g·cm-3×(a×10-7cm) 3,得出M = 5a3ρNA×10-22
g = ρ g·cm-3×(a×10-7cm) 3,得出M = 5a3ρNA×10-22
故答案为:![]() a;5a3ρNA×10-22。
a;5a3ρNA×10-22。

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案【题目】用图所示装置检验乙烯时不需要除杂的是

乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
【题目】某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如下图。加热聚丙烯废塑料得到的产物如下表:
产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
沸点(℃) | -252.8 | -146 | -103.7 | -47.4 | 80.10 | 110.63 | 4827 |

(1)甲试管中最终残留物是_____________。它有多种用途,如下列转化就可制取聚乙炔。写出反应②的化学方程式__________________________ 。
![]()
(2)乙中试管收集到的两种产品中,有一种能使酸性高锰酸钾溶液褪色的物质,该物质为__________。
(3)丙中锥形瓶观察到的现象_____________________________________。反应的化学方程式是__________________________、_________________________。
(4)经溴的四氯化碳溶液充分吸收,最后收集到的气体是______________。



