题目内容
5.向某密闭容器中加入0.30mol A、0.10mol C和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图甲所示.如图乙为t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各只改变一种条件,所改变的条件均不同.已知t3~t4阶段为使用催化剂.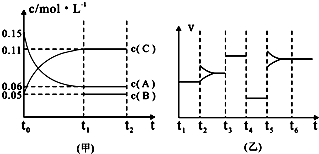
(1)若t1=20s,则t0~t1阶段以C浓度变化表示的反应速率为v(C)=0.003mol•L-1•s-1; t4~t5阶段改变的条件为减小压强、或增大体积;(t0为坐标原点)
(2)若t2~t3阶段,C的体积分数在不断地变小,则此阶段v(正)< v(逆) (填“>”、“=”、“<”); t3~t4的平衡常数K=2.8.
(3)t5~t6阶段改变的条件为升高温度;B的起始物质的量为0.04mol;
(4)t1达到平衡后,若保持容器温度和体积不变,再向容器中加入0.08mol A,0.2mol C,则平衡向正反应方向(填“向正反应方向”、“向逆反应方向”或“不”)移动.
(5)在温度和容积不变条件下,能判断该反应达到平衡的依据是CD
A.混合气体的平均相对分子质量不变 B.反应体系的总压强不变
C.生成2mol C的同时生成3mol A D.2v生成(A)=3v生成(C)
分析 (1)依据反应速率概念分析计算,v=$\frac{△c}{△t}$,结合图象书写化学方程式,t4~t5阶段改变条件,平衡不动,速率减小;
(2)若t2~t3阶段,C的体积分数在不断地变小说明平衡逆向进行,结合平衡常数概念计算得到,K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
(3)依据推导出的化学方程式计算,结合影响化学平衡的因素分析判断改变的条件;
(4)改变浓度,温度不变平衡常数不变,计算浓度商和平衡常数比较分析判断平衡进行方向;
(5)可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析.
解答 解:(1)若t1=20s,生成物C在t0~t1时间段的平均反应速率为:v(C)=$\frac{0.11mol/L-0.05mol/L}{20s}$=0.003mol•L-1•s-1;反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,反应中A与C的计量数之比为0.09:0.06=3:2,t3~t4阶段与t4~t5阶段正逆反应速率都相等,而t3~t4阶段为使用催化剂,则t4~t5阶段应为减小压强,则该反应中气体的化学计量数之和前后相等,则有:3A(g)?B(g)+2C(g),依据化学方程式可知,反应前后气体体积不变,t4~t5阶段改变体积平衡不动,说明是改变的压强,图象分析可知此阶段速率减小,则改变的体积为减小压强或增大体积,
故答案为:0.003mol•L-1•s-1 ;减小压强、或增大体积;
(2)若t2~t3阶段,C的体积分数在不断地变小说明平衡逆向进行,正反应速率小于逆反应速率,反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,反应中A与C的计量数之比为0.09:0.06=3:2,t3~t4阶段与t4~t5阶段正逆反应速率都相等,而t3~t4阶段为使用催化剂,则t4~t5阶段应为减小压强,则该反应中气体的化学计量数之和前后相等,则有:3A(g)?B(g)+2C(g),依据化学方程式书写计算t2-t3段的平衡常数即为t3~t4的平衡常数K=$\frac{c(B){c}^{2}(C)}{{c}^{3}(A)}$=$\frac{0.05mol/L×(0.11mol/L)^{2}}{(0.06mol/L)^{3}}$=2.8;
故答案为:<,2.8;
(3)如果增大反应物的浓度正反应速率变大,瞬间逆反应速率不变,根据图象可知t5~t6阶段应为升高温度;根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为2L,生成B的物质的量为0.06mol,平衡时B的物质的量为0.1mol,所以起始时B的物质的量为0.1mol-0.06mol=0.04mol;
故答案为:升高温度,0.04mol;
(4)t1达到平衡后,若保持容器温度和体积不变,再向容器中加入0.08mol A,0.2mol C,
Q=$\frac{c(B){c}^{2}(C)}{{c}^{3}(A)}$=$\frac{0.05×0.3{1}^{2}}{0.1{4}^{3}}$=1.75<K,说明平衡正向进行,
故答案为:向正反应方向;
(5)反应为3A(g)?B(g)+2C(g),是气体体积不变的反应
A.反应前后气体质量守恒,气体物质的量不变,所以混合气体的平均相对分子质量始终不变,不能说明反应达到平衡状态,故A错误;
B.反应前后气体物质的量不变,反应体系的总压强始终不变,不能说明反应达到平衡状态,故B错误;
C.生成2mol C的同时生成3mol A,说明正逆反应速率相同,能说明反应达到平衡状态,故C正确;
D.反应速率之比等于化学方程式计量数之比,AC速率之比等于3:2,为正反应速率之比,当2v生成(A)=3v生成(C)说明A反应和生成的速率相同为正逆反应速率相同,说明反应达到平衡状态,故D正确,
故答案为:CD;
点评 本题考查了化学平衡的影响因素分析判断,化学平衡常数、反应速率概念计算应用,掌握基础是关键,题目难度中等.

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案| A. | 微粒半径:X<X- | |
| B. | 简单氢化物的稳定性:Z比W的强 | |
| C. | W的氧化物的水化物的酸性一定比Z的强 | |
| D. | 最外层电子数由大到小的顺序为:Z、W、Y |
| A. | 实验室常用排饱和食盐水的方法收集氯气 | |
| B. | 工业合成氨控制温度在较高温度(500℃)进行 | |
| C. | 在浓氨水中加入烧碱可用于实验室快速生氨 | |
| D. | 工业上将二氧化硫转化为三氧化硫常通入过量空气 |
| A. | 若再加入X,平衡向正反应方向移动,Z在平衡混合物中的体积分数一定增大 | |
| B. | X的正反应速率是Y的逆反应速率的m/n倍 | |
| C. | 降低温度,混合气体的平均相对分子质量变小 | |
| D. | 通入稀有气体使压强增大,平衡将向正反应方向移动 |
| A. | ④⑤①②③ | B. | ①②③④⑤ | C. | ③④①②⑤ | D. | ②①④③⑤ |
| A. | 分散质粒子不能透过滤纸 | B. | 具有丁达尔效应 | ||
| C. | 分散质很快就沉降下来 | D. | 所得分散系是溶液 |
 .
.