题目内容
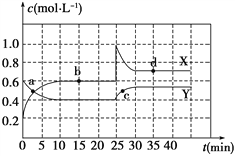
【题目】(1)实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定甲、乙两瓶溶液的成分,进行以下实验:取甲溶液,向其中缓慢滴入乙溶液,并边滴加边振荡,观察到开始无明显现象,后来有大量气体生成。实验过程中所发生反应的离子方程式为:___________________;甲是___________溶液,乙是____________溶液;
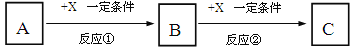
(2)为了达到下表所列的实验目的,请选择合适的实验方法,将其标号填在相应的空格中
____________;______________;____________;_______________;
【答案】CO32- + H+ = HCO3- HCO3- + H+ = H2O + CO2 ↑碳酸钠稀盐酸DCAB
【解析】
(1)当向盐酸中加入Na2CO3溶液时,发生反应2H++CO32-=CO2↑+H2O,盐酸完全反应后,再加入的Na2CO3不再放出CO2;向Na2CO3溶液中加入盐酸时,先发生反应CO32-+H+=HCO3-,当所有CO32-均转化为HCO3-时,再发生反应HCO3-+H+=CO2↑+H2O,开始无明显现象,后来有大量气体生成说明甲为HCl、乙为Na2CO3;
(2)氯化亚铁易被氧化为三价铁,三价铁离子遇硫氰化钾变红色;
食盐中少量细沙不溶于水,可溶于水后用过滤分离,然后蒸发结晶;
NaHCO3受热分解生成碳酸钠,故可用加热除去Na2CO3固体中少量的NaHCO3;铝粉可与氢氧化钠反应生成可溶性的偏铝酸钠,然后过滤得到镁;
故答案为:D;C;A;B。

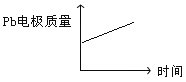
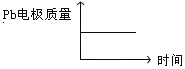
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外接电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:
铅蓄电池:Pb(s)+PbO2(s)+2H2SO4(aq)==2PbSO4(s)+2H2O(l);
电解池:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下各组判断正确的是( )
铅蓄电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
D |
|
|
A. A B. B C. C D. D