题目内容
4.二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的消毒剂,是一种黄绿色的气体,易溶于水.Ⅰ.(1)ClO2可由KClO3在H2SO4存在的条件下与Na2SO3反应制得.则该反应的氧化产物与还原产物的物质的量之比是1:2.
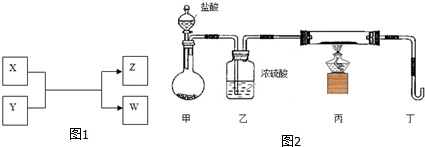
Ⅱ.实验室也可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2,其流程如图1:
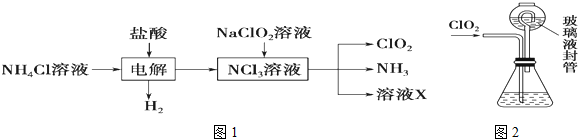
(2)写出电解时发生反应的化学方程式:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$3H2↑+NCl3.
(3)除去ClO2中的NH3可选用的试剂是C.(填序号)
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.水
(4)测定ClO2(如图2)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol•L-1硫代硫酸钠标准溶液滴定(I2+2S2O32-═2I-+S4O62-),共用去V mL硫代硫酸钠溶液.
①装置中玻璃液封管的作用是吸收残余的二氧化氯气体,并使锥形瓶内外压强相等.
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式2ClO2+10I-+8H+=2Cl-+5I2+4H2O.
③滴定终点的现象是溶液由无色变为蓝色,且半分钟内不褪去,且半分钟内不褪色.
④测得通入ClO2的质量m(ClO2)=1.35cv×10-2g.(用含c、V的代数式表示)
(5)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子ClO2-.2001年我国卫生部规定,饮用水的ClO2-含量应不超过0.2mg•L-1.若饮用水中ClO2-的含量超标,可向其中加入适量的Fe2+,该反应的氧化产物是Fe(OH)3(填化学式),其发生反应的离子方程式为4Fe2++ClO2-+2H2O+8OH-═4Fe(OH)3↓+Cl-.
分析 (1)在酸性条件下,亚硫酸钠和氯酸钾发生氧化还原反应生成硫酸钾、硫酸钠、二氧化氯和水,根据转移电子守恒判断;
(2)电解氯化铵和盐酸混合溶液时,根据流程图知生成氢气、和NCl3;
(3)由信息可知,ClO2易溶于水,所以不能利用水溶液吸收,氨气为碱性气体.据此判断;
(4)①用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等;
②由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水;
③溶液由无色变为蓝色,且半分钟内不褪去,说明滴定至终点;
④根据关系式2ClO2~5I2~10Na2S2O3计算n(ClO2),再根据m=nM计算m(ClO2);
(5)ClO2-具有氧化性,能把还原性的物质氧化生成高价态的物质,亚铁离子具有还原性被氧化成铁离子,形成氢氧化铁沉淀.
解答 解:(1)在酸性条件下,亚硫酸钠和氯酸钾发生氧化还原反应生成硫酸钾、硫酸钠、二氧化氯和水,该反应中硫元素化合价由+4价变为+6价,氯元素化合价由+5价变为+4价,根据转移电子守恒知该反应的氧化产物与还原产物的物质的量之比是1:2,
故答案为:1:2;
(2)电解氯化铵和盐酸混合溶液时,根据流程图知生成氢气、和NCl3,其电解反应方程式为:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$3H2↑+NCl3.
故答案为:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$3H2↑+NCl3;
(3)A、ClO2易溶于水,不能利用饱和食盐水吸收氨气,故A错误;
B、碱石灰不能吸收氨气,故B错误;
C、浓硫酸可以吸收氨气,且不影响ClO2,故C正确;
D、ClO2易溶于水,不能利用水吸收氨气,故D错误.
故选:C.
(4)①装置中玻璃液封管的作用是,用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等.
故答案为:吸收残余的二氧化氯气体,并使锥形瓶内外压强相等;
②由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水,反应离子方程式为2ClO2+10I-+8H+=2Cl-+5I2+4H2O,
故答案为:2ClO2+10I-+8H+=2Cl-+5I2+4H2O;
③溶液由无色变为蓝色,且半分钟内不褪去,说明滴定至终点,
故答案为:溶液由无色变为蓝色,且半分钟内不褪去,且半分钟内不褪色;
④VmLNa2S2O3溶液含有Na2S2O3物质的量为V•10-3 L×cmol/L=c•V•10-3 mol.则:
根据关系式:2ClO2~5I2~10Na2S2O3,
2 10
n(ClO2) c•V•10-3 mol
所以n(ClO2)=$\frac{1}{5}$c•V•10-3 mol.所以m(ClO2)=$\frac{1}{5}$c•V•10-3 mol×67.5g/mol=1.35cv×10-2g,
故答案为:1.35cv×10-2g;
(5)ClO2-具有氧化性,能把还原性的物质氧化生成高价态的物质,加入适量的Fe2+,亚铁离子具有还原性,且在PH为5.5~6.5生成沉淀而除去,在PH为5.5~6.5生成沉淀的物质有Fe(OH)3,其发生反应的离子方程式为:4Fe2++ClO2-+2H2O+8OH-═4Fe(OH)3↓+Cl-,
故答案为:Fe(OH)3;4Fe2++ClO2-+2H2O+8OH-═4Fe(OH)3↓+Cl-.
点评 本题考查阅读题目获取信息能力、氧化还原反应滴定及应用、对工艺流程及装置理解分析等,题目难度中等,要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力.注意氯及其化合物的性质,氧化还原反应知识的应用为高频考点.

| A. | 因SiO2不溶于水,故SiO2不是酸性氧化物 | |
| B. | 在反应SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑中SiO2作氧化剂 | |
| C. | SiO2是一种空间立体网状结构的晶体,熔点高、硬度大 | |
| D. | 氢氟酸能够刻蚀玻璃,故不能用玻璃瓶来盛装氢氟酸 |
| A. | 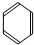 | B. | 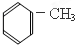 | C. | 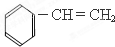 | D. | 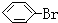 |
| A. | 硫元素既被氧化又被还原 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成1 mol Na2S2O3,转移4 mol电子 | |
| D. | 相同条件下,每吸收10 m3SO2就会放出2.5 m3CO2 |
| A. | 2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑ | B. | MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑ | ||
| C. | 3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe | D. | Cu+2FeCl3═CuCl2+2FeCl2 |
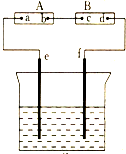 图中A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,C为盛有稀硫酸的电解槽,e、f为铂电极.接通电路后,发现B上的c点为红色.试回答:
图中A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,C为盛有稀硫酸的电解槽,e、f为铂电极.接通电路后,发现B上的c点为红色.试回答: