题目内容
【题目】原子序数依次增大的四种元素X、Y、Z、W分别处于第一至第四周期,自然界中存在多种X的化合物,Y原子核外电子有6种不同的运动状态,Y与Z可形成正四面体形分子,W的基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为_________。
(2)Z所在主族的四种元素分别与X形成的化合物,沸点由高到低的顺序是______(填化学式),呈现如此递变规律的原因是________________________________。
(3)Y元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为___,另一种的晶胞如图二所示,该晶胞的空间利用率为________________(保留两位有效数字)。(![]() )
)
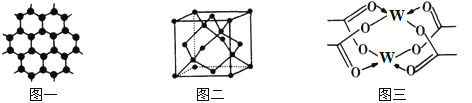
(4)W元素形成的单质,其晶体的堆积模型为___________,W的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是____________(填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向W的硫酸盐溶液中滴加过量氨水,观察到的现象是____________。请写出上述过程的离子方程式___________________________ ,___________________________________。
【答案】 ![]() HF>HI>HBr>HCl HF分子之间形成氢键,使其沸点较高,HCl、HBr、HI,分子间以分子间作用力结合,相对分子质量越大,范德华力越大,沸点越高 sp2 34% 面心立方最密堆积 ①②③ 先生成蓝色沉淀,继续加氨水,沉淀溶解,得到深蓝色透明溶液 Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+ Cu(OH)2+4NH3══ [Cu(NH3)4]2++2OH-
HF>HI>HBr>HCl HF分子之间形成氢键,使其沸点较高,HCl、HBr、HI,分子间以分子间作用力结合,相对分子质量越大,范德华力越大,沸点越高 sp2 34% 面心立方最密堆积 ①②③ 先生成蓝色沉淀,继续加氨水,沉淀溶解,得到深蓝色透明溶液 Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+ Cu(OH)2+4NH3══ [Cu(NH3)4]2++2OH-
【解析】试题分析:根据题意可知A是H;B是C;C是Cl;D是Cu。(1)这四种元素中电负性最大的元素是Cl,其基态原子的价电子排布图为![]() ;(2)C所在主族的前四种元素分别是F、Cl、Br、I它们与H形成的化合物是 HF、HCl、HBr、HI,同族元素形成的氢化物结构相似,都是由分子构成的物质,相对分子质量越大,分子间作用力就越大,物质的熔沸点就越高,而HF分子之间除了存在着一般的分子间作用力外,还存在着氢键,增加了分子之间的吸引力,使其熔沸点比HI还高。故这几种氢化物的沸点由高到低的顺序是HF>HI>HBr>HCl;呈现如此递变规律的原因是HF分子之间形成氢键,使共沸点较高,HCl、HBr、HI,分子量越大,范德华力越大,沸点越高。(3)B元素可形成多种单质,一种晶体结构如图一所示,该晶体是石墨晶体,由于每一个碳原子形成了2个碳碳单键和1个碳碳双键,所以其原子的杂化类型为sp2杂化;在一个晶胞中含有的该元素的原子个数是8×1+6×1/2+4=8,假设晶胞的边长为L,原子的半径为r,则该晶胞中晶胞边长与原子半径的关系是
;(2)C所在主族的前四种元素分别是F、Cl、Br、I它们与H形成的化合物是 HF、HCl、HBr、HI,同族元素形成的氢化物结构相似,都是由分子构成的物质,相对分子质量越大,分子间作用力就越大,物质的熔沸点就越高,而HF分子之间除了存在着一般的分子间作用力外,还存在着氢键,增加了分子之间的吸引力,使其熔沸点比HI还高。故这几种氢化物的沸点由高到低的顺序是HF>HI>HBr>HCl;呈现如此递变规律的原因是HF分子之间形成氢键,使共沸点较高,HCl、HBr、HI,分子量越大,范德华力越大,沸点越高。(3)B元素可形成多种单质,一种晶体结构如图一所示,该晶体是石墨晶体,由于每一个碳原子形成了2个碳碳单键和1个碳碳双键,所以其原子的杂化类型为sp2杂化;在一个晶胞中含有的该元素的原子个数是8×1+6×1/2+4=8,假设晶胞的边长为L,原子的半径为r,则该晶胞中晶胞边长与原子半径的关系是![]() ,则
,则![]() ,所以该晶胞的空间利用率为
,所以该晶胞的空间利用率为 ;(4)Cu元素形成的单质,其晶体的堆积模型为面心立方最密堆积;根据Cu的醋酸盐晶体局部结构图示可知该晶体中含有的化学键是极性键、非极性键、配位键,因此选项是①②③。(5)向CuSO4溶液中滴加过量氨水,首先发生反应Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+,看到溶液产生蓝色沉淀,后发生反应: Cu(OH)2+4NH3══ [Cu(NH3)4]2++2OH-,沉淀溶解,变为蓝色溶液;
;(4)Cu元素形成的单质,其晶体的堆积模型为面心立方最密堆积;根据Cu的醋酸盐晶体局部结构图示可知该晶体中含有的化学键是极性键、非极性键、配位键,因此选项是①②③。(5)向CuSO4溶液中滴加过量氨水,首先发生反应Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+,看到溶液产生蓝色沉淀,后发生反应: Cu(OH)2+4NH3══ [Cu(NH3)4]2++2OH-,沉淀溶解,变为蓝色溶液;