题目内容
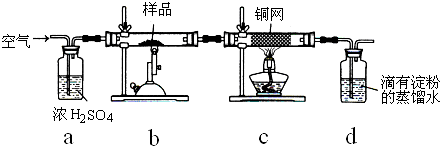
 某同学设计了如图所示装置(部分夹持装置已略去)进行实验研究.请回答:
某同学设计了如图所示装置(部分夹持装置已略去)进行实验研究.请回答:(1)用上述装置探究影响化学反应速率的因素.
①圆底烧瓶中发生反应的离子方程式是
Zn+2H+=Zn2++H2↑
Zn+2H+=Zn2++H2↑
.②用上述装置进行实验,以生成9.0mL气体为计时终点,结果为t1>t2.
| 序号 | V(H2SO4)/mL | C(H2SO4)/mol?L-1 | t/s |
| I | 40 | 1 | t1 |
| II | 40 | 4 | t2 |
在其它条件一定时,化学反应速率随反应物浓度的增大而增大
在其它条件一定时,化学反应速率随反应物浓度的增大而增大
.实验过程中,对量气管的操作是
调整量气管,使其左右管中水面始终持平
调整量气管,使其左右管中水面始终持平
.③若将锌片换成含杂质的粗锌片,且控制其他条件使其与上述实验完全一致,所测得的反应速率均大于上述实验对应的数据.粗锌片中所含杂质可能是(填序号)
abc
abc
.A.石墨 b.银 c.铜d.沙粒(二氧化硅)
(2)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀.
①圆底烧瓶中的试剂可选用(填序号)
ac
ac
.a.NaOH溶液 b.C2H5OH c.NaCl溶液 d.稀硫酸
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是
量气管右端液面下降,左端液面上升
量气管右端液面下降,左端液面上升
.分析:(1)①锌与稀硫酸反应生成硫酸锌和氢气;
②t1>t2,说明实验Ⅱ反应速率较大,结合浓度的影响判断;对量气管读数时,要注意调整左右两管的液面高度相平;
③所含杂质能与锌形成原电池反应;
(2)①发生吸氧腐蚀应在碱性或中性溶液中进行;
②发生吸氧腐蚀时,消耗氧气,量气管右端液面下降,左端液面上升.
②t1>t2,说明实验Ⅱ反应速率较大,结合浓度的影响判断;对量气管读数时,要注意调整左右两管的液面高度相平;
③所含杂质能与锌形成原电池反应;
(2)①发生吸氧腐蚀应在碱性或中性溶液中进行;
②发生吸氧腐蚀时,消耗氧气,量气管右端液面下降,左端液面上升.
解答:解:(1)①锌与稀硫酸反应生成硫酸锌和氢气,反应的离子方程式为Zn+2H+=Zn2++H2↑,故答案为:Zn+2H+=Zn2++H2↑;
②t1>t2,说明实验Ⅱ反应速率较大,二者浓度不同,说明在其它条件一定时,化学反应速率随反应物浓度的增大而增大,对量气管读数时,要注意调整左右两管的液面高度相平,且视线与液面相平,
故答案为:在其它条件一定时,化学反应速率随反应物浓度的增大而增大;调整量气管,使其左右管中水面始终持平;
③由反应速率大于上述实验对应的数据可知所含杂质必能与锌形成原电池,使反应速率增大,所含杂质可以是石墨、银、铜等,
故答案为:abc;
(2)①钢铁在中性或弱碱性环境中易发生吸氧腐蚀,故答案为:ac;
②吸氧腐蚀消耗氧气,故量气管右端液面下降,左端液面上升,故答案为:量气管右端液面下降,左端液面上升.
②t1>t2,说明实验Ⅱ反应速率较大,二者浓度不同,说明在其它条件一定时,化学反应速率随反应物浓度的增大而增大,对量气管读数时,要注意调整左右两管的液面高度相平,且视线与液面相平,
故答案为:在其它条件一定时,化学反应速率随反应物浓度的增大而增大;调整量气管,使其左右管中水面始终持平;
③由反应速率大于上述实验对应的数据可知所含杂质必能与锌形成原电池,使反应速率增大,所含杂质可以是石墨、银、铜等,
故答案为:abc;
(2)①钢铁在中性或弱碱性环境中易发生吸氧腐蚀,故答案为:ac;
②吸氧腐蚀消耗氧气,故量气管右端液面下降,左端液面上升,故答案为:量气管右端液面下降,左端液面上升.
点评:本题考查化学反应速率以及金属的电化学腐蚀的实验探究,答题时注意实验数据的处理、分析,把握实验原理、根据实验现象得出实验结论.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
 国务院强调,“南水北调”工程必须坚持节水、治污和生态环境保护与工程建设相协调,以水资源合理配置为主线,把节水、治污、生态环境保护与调水作为一个完整的系统来分析的原则.在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中,含有大量的Mg2+、Al3+、Cu2+、Ag+.试分析回答下列问题:
国务院强调,“南水北调”工程必须坚持节水、治污和生态环境保护与工程建设相协调,以水资源合理配置为主线,把节水、治污、生态环境保护与调水作为一个完整的系统来分析的原则.在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中,含有大量的Mg2+、Al3+、Cu2+、Ag+.试分析回答下列问题: 某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题: 某同学设计了如图所示的实验装置来粗略地测定电石中碳化钙的质量分数.
某同学设计了如图所示的实验装置来粗略地测定电石中碳化钙的质量分数.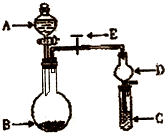 (2010?临沂一模)化学实验中一套装置往往可以完成多个实验,A某同学设计了如图所示装置(夹持仪器省略)进行系列实验.请回答:
(2010?临沂一模)化学实验中一套装置往往可以完成多个实验,A某同学设计了如图所示装置(夹持仪器省略)进行系列实验.请回答: