题目内容
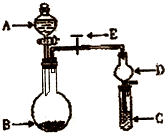 (2010?临沂一模)化学实验中一套装置往往可以完成多个实验,A某同学设计了如图所示装置(夹持仪器省略)进行系列实验.请回答:
(2010?临沂一模)化学实验中一套装置往往可以完成多个实验,A某同学设计了如图所示装置(夹持仪器省略)进行系列实验.请回答:(1)指出下列仪器的名称:
A
分液漏斗
分液漏斗
;D
干燥管
干燥管
.(2)若A中为浓氨水,B中为烧碱,C中为AICl3溶液,实验中可观测到B中有气体生成,C中有白色沉淀.则C中发生反应的离子方程式为
Al3++3NH3?H2O═Al(OH)3+3NH4+
Al3++3NH3?H2O═Al(OH)3+3NH4+
,仪器D的作用为防止倒吸
防止倒吸
.(3)若A中装有浓盐酸,B中装有固体KMn04,C中盛有KI淀粉溶液,实验中可观测到B中出现黄绿色气体,C中溶液变蓝.依据实验现象可以得到的结论为:
删除此空
删除此空
;氧化性由强到弱的顺序:
KMnO4>Cl2>I2
KMnO4>Cl2>I2
;但该装置的不足之处是:
缺少尾气吸收装置
缺少尾气吸收装置
.分析:(1)根据图及化学常用仪器的结构来解答;
(2)烧碱与氨水混合,溶液中氢氧根浓度增大,放出大量的热,利与氨气挥发,挥发的氨气在C中于溶于水与氯化铝反应生成氢氧化铝白色沉淀,导致装置内压强降低,仪器D可防止倒吸.
(3)B中出现黄绿色气体,说明浓盐酸与KMn04反应生成氯气.C中溶液变蓝,说明氯气在C中氧化碘离子生成碘单质.利用氧化剂的氧化性强于氧化产物的氧化性,判断物质的氧化性.
氯气有毒,不能将尾气直接排放到大气中.
(2)烧碱与氨水混合,溶液中氢氧根浓度增大,放出大量的热,利与氨气挥发,挥发的氨气在C中于溶于水与氯化铝反应生成氢氧化铝白色沉淀,导致装置内压强降低,仪器D可防止倒吸.
(3)B中出现黄绿色气体,说明浓盐酸与KMn04反应生成氯气.C中溶液变蓝,说明氯气在C中氧化碘离子生成碘单质.利用氧化剂的氧化性强于氧化产物的氧化性,判断物质的氧化性.
氯气有毒,不能将尾气直接排放到大气中.
解答:解:(1)由图可知A为分液漏斗,D为干燥管,
故答案为:分液漏斗; 干燥管;
(2)挥发的氨气在C中于溶于水与氯化铝反应生成氢氧化铝白色沉淀,反应离子方程式为
Al3++3NH3?H2O═Al(OH)3+3NH4+,
氨气反应导致装置内压强降低,易导致溶液倒吸,仪器D可防止倒吸,
故答案为:Al3++3NH3?H2O═Al(OH)3+3NH4+;防止倒吸;
(3)B中出现黄绿色气体,说明浓盐酸与KMn04反应被氧化生成氯气.C中溶液变蓝,说明氯气在C中氧化碘离子生成碘单质.所以可得氧化性强弱顺序为KMnO4>Cl2>I2,氯气有毒,不能将尾气直接排放到大气中,实验缺少尾气吸收装置,
故答案为:KMnO4>Cl2>I2;缺少尾气吸收装置.
故答案为:分液漏斗; 干燥管;
(2)挥发的氨气在C中于溶于水与氯化铝反应生成氢氧化铝白色沉淀,反应离子方程式为
Al3++3NH3?H2O═Al(OH)3+3NH4+,
氨气反应导致装置内压强降低,易导致溶液倒吸,仪器D可防止倒吸,
故答案为:Al3++3NH3?H2O═Al(OH)3+3NH4+;防止倒吸;
(3)B中出现黄绿色气体,说明浓盐酸与KMn04反应被氧化生成氯气.C中溶液变蓝,说明氯气在C中氧化碘离子生成碘单质.所以可得氧化性强弱顺序为KMnO4>Cl2>I2,氯气有毒,不能将尾气直接排放到大气中,实验缺少尾气吸收装置,
故答案为:KMnO4>Cl2>I2;缺少尾气吸收装置.
点评:本题以实验为载体,考查对仪器认识、元素化合物知识、氧化性比较、对实验装置的评价等,题目难度不大,注意基础知识掌握.

练习册系列答案
相关题目
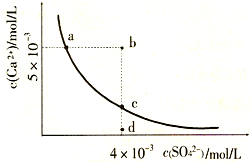 (2010?临沂一模)常温下,Ksp(CaS04)=9×l0-6,常温下CaS04在水中的沉淀溶解平衡曲线如图.下列说法正确的是( )
(2010?临沂一模)常温下,Ksp(CaS04)=9×l0-6,常温下CaS04在水中的沉淀溶解平衡曲线如图.下列说法正确的是( )
 (2010?临沂一模)某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验以下实验:将pH═2的两种酸溶液HA,HB和pH=12的MOH碱溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题:
(2010?临沂一模)某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验以下实验:将pH═2的两种酸溶液HA,HB和pH=12的MOH碱溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题: