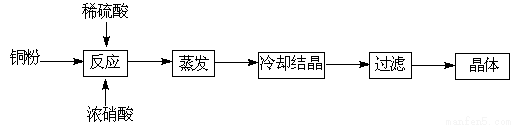
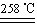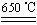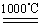题目内容
金属镁及其化合物不仅在国防上有重要应用,在化学研究中也有广泛应用。
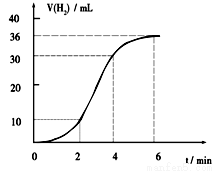
(1)某同学研究反应速率时用如下方法:取一段镁条,用砂纸擦去表面的氧化膜,使足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图所示。镁与盐酸反应的离子方程式为 ;在前4min内,镁条与盐酸的反应速率逐渐加快,在4 min之后,反应速率逐渐减慢,请简述其原因:_____________。
(2)向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解,写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。
(3)Mg Al可形成原电池:
编号 | 电极材料 | 电解质溶液 | 电子流动 方向 |
1 | Mg Al | 稀盐酸 | Mg流向Al |
2 | Mg Al | NaOH溶液 |
|
根据上表中的实验现象完成下列问题:
①实验1中Mg为 极;
②实验2中电子流动方向 ,Al为 极,为什么? 。
(1)Mg+2H+=Mg2++H2↑(1分)
镁和盐酸反应是放热反应,随着反应体系温度升高,反应速率增大(1分);
4min后由于溶液中H+浓度降低,所以导致反应速率减小(1分)。
(2)Mg(OH)2(s)+2NH4+=Mg2++2NH3·H2O(2分)
(3) ① 负极(1分)
②Al流向Mg(1分),负(1分),Al能和NaOH溶液反应而Mg不能,故Al作负极,Mg作正极。(2分)
【解析】
试题分析:(1)镁与盐酸发生置换反应,离子方程式为:Mg+2H+=Mg2++H2↑;因为金属与酸的置换反应为放热反应,所以镁与盐酸反应放热,随着反应体系温度升高,反应速率增大,随着反应的进行,H+浓度降低,4min后浓度对反应速率的影响为主要因素,反应速率减小。
(2)NH4+结合OH?,使Mg(OH)2的沉淀溶解平衡向右移动:Mg(OH)2(s)+2NH4+=Mg2++2NH3·H2O
(3) ①实验1在稀盐酸中,Mg比Al活泼,所以Mg为负极。
②实验2中,Al容易与NaOH溶液反应,而Mg不与NaOH溶液反应,所以Al为负极,则电子流动方向为:Al流向Mg。
考点:本题考查离子方程式的书写、条件对反应速率的影响、原电池原理。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案