题目内容
下列说法错误的是
A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH小于4
B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C.用0.200 mol·L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和
D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度: ④>①>②>③
B
【解析】
试题分析:A、稀释醋酸,促进电离平衡向右移动,所以将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH小于4,正确;B、NaHA为酸式盐,无法根据溶液的酸碱性判断H2A是强酸还是弱酸,错误;C、因为CH3COONa水解显碱性,所以反应至中性时,溶液中的酸未被完全中和,正确;D、因为Ag+与Cl?浓度之积为常数,所以Cl?浓度越大,Ag+浓度越小,所以Ag+浓度: ④>①>②>③,正确。
考点:本题考查弱电解质的电离、弱酸的判断、酸碱中和反应、离子浓度比较。

 阅读快车系列答案
阅读快车系列答案金属镁及其化合物不仅在国防上有重要应用,在化学研究中也有广泛应用。
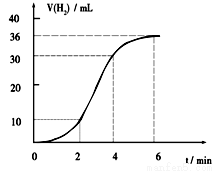
(1)某同学研究反应速率时用如下方法:取一段镁条,用砂纸擦去表面的氧化膜,使足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图所示。镁与盐酸反应的离子方程式为 ;在前4min内,镁条与盐酸的反应速率逐渐加快,在4 min之后,反应速率逐渐减慢,请简述其原因:_____________。
(2)向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解,写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。
(3)Mg Al可形成原电池:
编号 | 电极材料 | 电解质溶液 | 电子流动 方向 |
1 | Mg Al | 稀盐酸 | Mg流向Al |
2 | Mg Al | NaOH溶液 |
|
根据上表中的实验现象完成下列问题:
①实验1中Mg为 极;
②实验2中电子流动方向 ,Al为 极,为什么? 。