题目内容
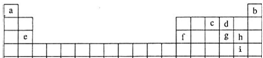
如表是元素周期表的一部分.X、Y、Z、W均为短周期元素,它们的质 子数之和为46.下列说法正确的是( )
| x | y | ||
| z | w |
| A、原子半径:W<X |
| B、气态氢化物的稳定性:Y<Z |
| C、最髙化合价:X<Y |
| D、最髙价氧化物对应的水化物的酸性:Z<W |
分析:X、Y、Z、W均为短周期元素,由元素在周期表中的位置,可知X、Y处于第二周期,Z、W处于第三周期,令X的质子数为a,则Y的质子数为a+2、Z的质子数为a+7、W的质子数为a+9,四元素质子数之和为46,则a+a+2+a+7+a+9=46,解得a=7,故X为N元素、Y为F元素、Z为Si元素、W为S元素,据此解答.
解答:解:X、Y、Z、W均为短周期元素,由元素在周期表中的位置,可知X、Y处于第二周期,Z、W处于第三周期,令X的质子数为a,则Y的质子数为a+2、Z的质子数为a+7、W的质子数为a+9,四元素质子数之和为46,则a+a+2+a+7+a+9=46,解得a=7,故X为N元素、Y为F元素、Z为Si元素、W为S元素,
A.处于相邻族,电子层越多原子半径越大,故原子半径S>N,故A错误;
B.同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故非金属性F>Si,非金属性越强氢化物越稳定,故氢化物稳定性HF>SiH4,故B错误;
C.Y为F元素,没有正化合价,故C错误;
D.同周期自左而右非金属性增强,故非金属性S>Si,非金属性越强最高价含氧酸的酸性越强,故酸性H2SO4>H2SiO3,故D正确;
故选D.
A.处于相邻族,电子层越多原子半径越大,故原子半径S>N,故A错误;
B.同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故非金属性F>Si,非金属性越强氢化物越稳定,故氢化物稳定性HF>SiH4,故B错误;
C.Y为F元素,没有正化合价,故C错误;
D.同周期自左而右非金属性增强,故非金属性S>Si,非金属性越强最高价含氧酸的酸性越强,故酸性H2SO4>H2SiO3,故D正确;
故选D.
点评:本题考查结构性质位置关系应用,难度中等,推断元素是解题关键,注意掌握同主族元素原子序数关系,注意氟元素没有正化合价.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目

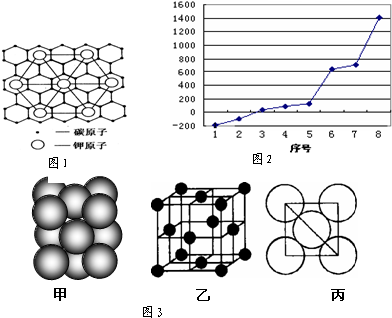
 它的空间利用率为
它的空间利用率为