题目内容
(2008?安庆模拟)如表是元素周期表的一部分,其中所列字母分别代表某一元素.请你根据表中所给元素,回答下列问题:
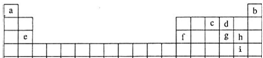
(1)“大爆炸理论”指出:200亿年以前,宇宙中所有物质都包含在一个密度无限大,温度无限高的原始核中,由于某种原因它发生了爆炸,首先产生了中子、质子和电子,随后就产生了元素.你由此可知最先产生的元素是
(2)e、f单质及ef合金中硬度最大的是
(3)请写出原子核外最外层电子数为最内层电子数3倍的元素原子的核外电子排布式:
(4)比较表中cdg三种元素的第一电离能的大小顺序
(5)请写出能验证h和i非金属性强弱的一个化学反应的离子方程式
(6)用来组成酸、碱、盐三类物质至少需要的元素有

(1)“大爆炸理论”指出:200亿年以前,宇宙中所有物质都包含在一个密度无限大,温度无限高的原始核中,由于某种原因它发生了爆炸,首先产生了中子、质子和电子,随后就产生了元素.你由此可知最先产生的元素是
a
a
(填写表中字母).(2)e、f单质及ef合金中硬度最大的是
镁铝合金
镁铝合金
(填写名称).(3)请写出原子核外最外层电子数为最内层电子数3倍的元素原子的核外电子排布式:
1s22s22p63s23p4
1s22s22p63s23p4
,该元素低价氧化物在一定条件下转化为高价氧化物的反应为工业重要反应,请写出此反应的化学方程式2SO2+O2
2SO3
| ||
| △ |
2SO2+O2
2SO3
.
| ||
| △ |
(4)比较表中cdg三种元素的第一电离能的大小顺序
c>d>g(或N>O>S)
c>d>g(或N>O>S)
.(5)请写出能验证h和i非金属性强弱的一个化学反应的离子方程式
Cl2+2Br-=2Cl-+Br2
Cl2+2Br-=2Cl-+Br2
.(6)用来组成酸、碱、盐三类物质至少需要的元素有
acd
acd
(填写表中字母).分析:根据元素周期表知,a、b、c、d、e、f、g、h、i所代表的元素分别为H、He、N、O、Mg、Al、S、Cl、Br.
(1)构成最简单的原子也就是最容易构成的原子.
(2)合金的硬度大于合金中任一金属的硬度.
(3)如果最外层是第二电子层,原子核外最外层电子数为最内层电子数3倍的元素原子是O原子,但 不符合题意;如果最外层是第三电子层,该原子是S,符合题意,再根据构造原理写出其核外电子排布式;该元素低价氧化物为二氧化硫,二氧化硫能被氧气氧化成三氧化硫.
(4)同一周期,元素的第一电离能随着原子序数的增大而增大,但第ⅡA族的第一电离能大于第ⅢA族,第ⅤA族的第一电离能大于第ⅥA族的;同一主族,第一电离能随着原子序数的增大而减小.
(5)根据非金属之间的置换反应判断,非金属性越强,其氧化性越强,据此分析.
(6)酸的组成中必有氢元素,碱中必有氢氧,盐中有酸根阴离子和金属阳离子或铵根离子,据此分析判断.
(1)构成最简单的原子也就是最容易构成的原子.
(2)合金的硬度大于合金中任一金属的硬度.
(3)如果最外层是第二电子层,原子核外最外层电子数为最内层电子数3倍的元素原子是O原子,但 不符合题意;如果最外层是第三电子层,该原子是S,符合题意,再根据构造原理写出其核外电子排布式;该元素低价氧化物为二氧化硫,二氧化硫能被氧气氧化成三氧化硫.
(4)同一周期,元素的第一电离能随着原子序数的增大而增大,但第ⅡA族的第一电离能大于第ⅢA族,第ⅤA族的第一电离能大于第ⅥA族的;同一主族,第一电离能随着原子序数的增大而减小.
(5)根据非金属之间的置换反应判断,非金属性越强,其氧化性越强,据此分析.
(6)酸的组成中必有氢元素,碱中必有氢氧,盐中有酸根阴离子和金属阳离子或铵根离子,据此分析判断.
解答:解:(1)构成最简单的原子也就是最容易构成的原子,最简单的原子是氢原子.
故答案为:a.
(2)合金的硬度大于合金中任一金属的硬度,所以e、f单质及ef合金中硬度最大的是镁铝合金.
故答案为:镁铝合金.
(3)如果最外层是第二电子层,原子核外最外层电子数为最内层电子数3倍的元素原子是O原子,但不符合题意;如果最外层是第三电子层,该原子是S,符合题意;其核外电子排布式为:1s22s22p63s23p4.
该元素低价氧化物为二氧化硫,二氧化硫和氧气能发生氧化还原反应生成三氧化硫,
反应方程式为:2SO2+O2
2SO3.
故答案为:1s22s22p63s23p4;2SO2+O2
2SO3.
(4)同一周期,元素的第一电离能随着原子序数的增大而增大,但第ⅡA族的第一电离能大于第ⅢA族,第ⅤA族的第一电离能大于第ⅥA族的;同一主族,第一电离能随着原子序数的增大而减小,N、O元素属于同一周期,N元素属于第ⅤA族,O元素属于第ⅥA族,所以氮元素的第一电离能大于氧元素的;O、S元素属于同一主族,且硫元素的原子序数大于氧元素的,所以氧元素的第一电离能大于硫元素的,所以cdg三种元素的第一电离能的大小顺序为c>d>g(或N>O>S).
故答案为:c>d>g(或N>O>S).
(5)h和i属于同一主族,元素的非金属性越强,其氧化性越强,只要氯气能置换溴单质即可证明氯元素的非金属性强于溴元素的,离子反应方程式为:Cl2+2Br-=2Cl-+Br2.
故答案为:Cl2+2Br-=2Cl-+Br2.
(6)酸的组成中必有氢元素,碱中必有氢氧,盐中有酸根阴离子和金属阳离子或铵根离子,酸中必须至少还有一种元素,若盐中含有金属阳离子,这样至少含有4种元素;若盐中含有铵根离子,酸根离子为硝酸根离子,这样至少含有3种元素,所以用来组成酸、碱、盐三类物质至少需要的元素有三种,即acd.
故答案为:acd.
故答案为:a.
(2)合金的硬度大于合金中任一金属的硬度,所以e、f单质及ef合金中硬度最大的是镁铝合金.
故答案为:镁铝合金.
(3)如果最外层是第二电子层,原子核外最外层电子数为最内层电子数3倍的元素原子是O原子,但不符合题意;如果最外层是第三电子层,该原子是S,符合题意;其核外电子排布式为:1s22s22p63s23p4.
该元素低价氧化物为二氧化硫,二氧化硫和氧气能发生氧化还原反应生成三氧化硫,
反应方程式为:2SO2+O2
| ||
| △ |
故答案为:1s22s22p63s23p4;2SO2+O2
| ||
| △ |
(4)同一周期,元素的第一电离能随着原子序数的增大而增大,但第ⅡA族的第一电离能大于第ⅢA族,第ⅤA族的第一电离能大于第ⅥA族的;同一主族,第一电离能随着原子序数的增大而减小,N、O元素属于同一周期,N元素属于第ⅤA族,O元素属于第ⅥA族,所以氮元素的第一电离能大于氧元素的;O、S元素属于同一主族,且硫元素的原子序数大于氧元素的,所以氧元素的第一电离能大于硫元素的,所以cdg三种元素的第一电离能的大小顺序为c>d>g(或N>O>S).
故答案为:c>d>g(或N>O>S).
(5)h和i属于同一主族,元素的非金属性越强,其氧化性越强,只要氯气能置换溴单质即可证明氯元素的非金属性强于溴元素的,离子反应方程式为:Cl2+2Br-=2Cl-+Br2.
故答案为:Cl2+2Br-=2Cl-+Br2.
(6)酸的组成中必有氢元素,碱中必有氢氧,盐中有酸根阴离子和金属阳离子或铵根离子,酸中必须至少还有一种元素,若盐中含有金属阳离子,这样至少含有4种元素;若盐中含有铵根离子,酸根离子为硝酸根离子,这样至少含有3种元素,所以用来组成酸、碱、盐三类物质至少需要的元素有三种,即acd.
故答案为:acd.
点评:本题考查了核外电子排布式的书写、离子方程式的书写、电离能大小的判断等知识点,难度较大,易错题是(4)题,注意同一周期元素第一电离能的规律及异常现象.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
(2008?安庆模拟)下列实验操作正确且能达到预期目的是( )
|