题目内容
如表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
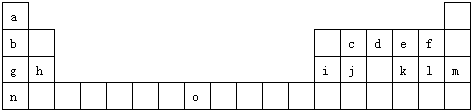
试回答下列问题:
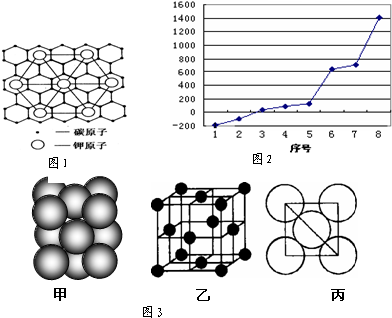
(1)请写出元素O的基态原子电子排布式 .
(2)c元素的一种同素异形体与熔融的n单质形成石墨间隙化合物,比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,其平面图形见图1,则x值为 .
(3)第三周期8种元素按单质熔点高低的顺序如图2,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填右图中的序号).
(4)由i原子跟d原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.则i与d形成的晶体中一个晶胞中含有4个i原子;与同一个i原子相连的d原子构成的空间构型为 ,d原子的杂化类型为 .
(5)i单质晶体中原子的堆积方式如图3甲所示,其晶胞特征如图3乙所示,原子之间相互位置关系的平面图如图3丙所示.若已知i的原子半径为dcm,NA代表阿伏加德罗常数,i的相对原子质量为M,则该晶体的密度为 _g/cm3 (用字母表示).

试回答下列问题:

(1)请写出元素O的基态原子电子排布式
(2)c元素的一种同素异形体与熔融的n单质形成石墨间隙化合物,比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,其平面图形见图1,则x值为
(3)第三周期8种元素按单质熔点高低的顺序如图2,其中序号“8”代表
(4)由i原子跟d原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.则i与d形成的晶体中一个晶胞中含有4个i原子;与同一个i原子相连的d原子构成的空间构型为
(5)i单质晶体中原子的堆积方式如图3甲所示,其晶胞特征如图3乙所示,原子之间相互位置关系的平面图如图3丙所示.若已知i的原子半径为dcm,NA代表阿伏加德罗常数,i的相对原子质量为M,则该晶体的密度为
分析:根据元素周期表知,a-o各元素分别是H、Li、C、N、O、F、Na、Mg、Al、Si、S、Cl、Ar、K、Fe.
(1)Fe原子核外电子数为26,根据能量最低原理书写核外电子排布式;
(2)可以取三个钾原子形成的小三角形为计算单位,其完全占有的碳原子数是4,每个K为6个小三角形共用,利用均摊法计算K原子个数,据此解答;
(3)第三周期8种元素的单质中只有Si为原子晶体,熔沸点最大;
同周期随原子序数增大,电负性增大,故Cl元素电负性最大,氯气的沸点仅高于氩;
(3)AlN晶体与金刚石类似,每个Al原子与个N原子相连,为空间网状结构,与同一个Al原子相连的N原子构成正四面体;N原子成4个共价键(存在配位键),不含孤对电子,采取sp3杂化;
(5)利用均摊法计算晶胞中含有的原子个数,进而计算晶胞中含有原子的质量,Al的原子半径为dcm,由图丙可知,晶胞的棱长=4d cm×
=2
d cm,再计算晶胞的体积,再根据密度公式计算其密度.
(1)Fe原子核外电子数为26,根据能量最低原理书写核外电子排布式;
(2)可以取三个钾原子形成的小三角形为计算单位,其完全占有的碳原子数是4,每个K为6个小三角形共用,利用均摊法计算K原子个数,据此解答;
(3)第三周期8种元素的单质中只有Si为原子晶体,熔沸点最大;
同周期随原子序数增大,电负性增大,故Cl元素电负性最大,氯气的沸点仅高于氩;
(3)AlN晶体与金刚石类似,每个Al原子与个N原子相连,为空间网状结构,与同一个Al原子相连的N原子构成正四面体;N原子成4个共价键(存在配位键),不含孤对电子,采取sp3杂化;
(5)利用均摊法计算晶胞中含有的原子个数,进而计算晶胞中含有原子的质量,Al的原子半径为dcm,由图丙可知,晶胞的棱长=4d cm×
| ||
| 2 |
| 2 |
解答:解:(1)Fe原子核外电子数为26,根据能量最低原理可知,其核外电子排布式为:1s22s22p63s23p63d64s2,
故答案为:1s22s22p63s23p63d64s2;
(2)可以取三个钾原子形成的小三角形为计算单位,其完全占有的碳原子数是4,每个K为6个小三角形共用,占有的钾原子数为
×3=
,故碳原子数和钾原子数之比是4:
=8:1,故x=8,
故答案为:8;
(3)第三周期8种元素的单质中只有Si为原子晶体,熔沸点最大,由图可知序号“8”代表的为Si;同周期随原子序数增大,电负性增大,故Cl元素电负性最大,氯气的沸点仅高于氩,故序号“2”为Cl,
故答案为:Si;2.
(4)AlN晶体与金刚石类似,每个Al原子与个N原子相连,为空间网状结构,与同一个Al原子相连的N原子构成正四面体;N原子成4个共价键(存在配位键),不含孤对电子,采取sp3杂化,
故答案为:正四面体;sp3;
(5)由晶胞结构可知,晶胞中Al原子的数目为8×
+6×
=4,该晶胞中原子的质量=4×
g,由信息可知晶胞图可知为面心立方,Al的原子半径为dcm,由图丙可知,晶胞的棱长=4d cm×
=2
d cm,故晶胞的体积=(2
d cm)3=16
d3 cm3,所以其密度=
=
g/cm3,
故答案为:
.
故答案为:1s22s22p63s23p63d64s2;
(2)可以取三个钾原子形成的小三角形为计算单位,其完全占有的碳原子数是4,每个K为6个小三角形共用,占有的钾原子数为
| 1 |
| 6 |
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:8;
(3)第三周期8种元素的单质中只有Si为原子晶体,熔沸点最大,由图可知序号“8”代表的为Si;同周期随原子序数增大,电负性增大,故Cl元素电负性最大,氯气的沸点仅高于氩,故序号“2”为Cl,
故答案为:Si;2.
(4)AlN晶体与金刚石类似,每个Al原子与个N原子相连,为空间网状结构,与同一个Al原子相连的N原子构成正四面体;N原子成4个共价键(存在配位键),不含孤对电子,采取sp3杂化,
故答案为:正四面体;sp3;
(5)由晶胞结构可知,晶胞中Al原子的数目为8×
| 1 |
| 8 |
| 1 |
| 2 |
| M |
| NA |
| ||
| 2 |
| 2 |
| 2 |
| 2 |
4×
| ||
16
|
| M | ||
4
|
故答案为:
| M | ||
4
|
点评:本题考查物质结构与性质,涉及核外电子排布、晶胞结构与计算、元素周期律、晶体类型与单质熔沸点的关系等知识点,(4)中AlN的结构为难点,(5)中计算的关键是确定晶胞的棱长,难点中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

 它的空间利用率为
它的空间利用率为