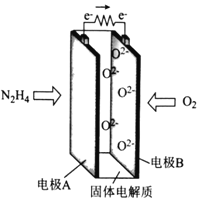
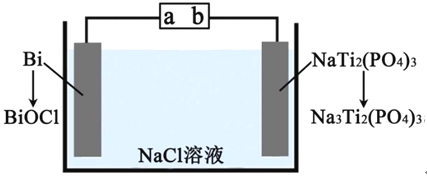
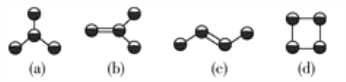
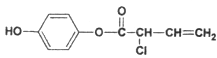
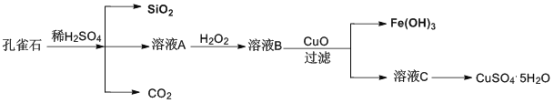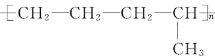题目内容
【题目】10mL某气态烯烃在50mLO2里充分燃烧,得到液态水和体积为35mL的混合气体(同温同压下测定),该气态烯烃是( )
A. 乙烯B. 丙烯C. 1-丁烯D. 2-丁烯
【答案】B
【解析】
烃类物质碳原子个数一般小于4的为气体,令烃的分子式为CxHy,烃充分燃烧生成液态水和体积为35mL的混合气体,则只能有氧气剩余,充分燃烧:CxHy+(x+y/4)O2![]() xCO2+y/2H2O,则x+y/4<5,根据方程式CxHy+(x+y/4)O2
xCO2+y/2H2O,则x+y/4<5,根据方程式CxHy+(x+y/4)O2![]() xCO2+y/4H2O(l)利用体积差量计算判断。
xCO2+y/4H2O(l)利用体积差量计算判断。
令烃的分子式为CxHy,烃充分燃烧生成液态水和体积为35mL的混合气体,则只能有氧气剩余,故烃完全燃烧,有氧气剩余,则x+y/4<5,
CxHy+(x+y/4)O2![]() xCO2+y/2H2O(l) 气体体积减小△V
xCO2+y/2H2O(l) 气体体积减小△V
1 1+y/4
10mL 60mL-35mL=25mL
10mL:25mL=1:(1+y/4) 解得y=6,
由于x+y/4<5,所以x<3.5,故x=2或3,故为乙烷或丙烯。
故选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】元素周期律与周期表是学习元素化合物知识的重要工具。C与Si,N与P分别位于同一主族。其气态氢化物的分解温度如下表:
物质 | CH4 | SiH4 | NH3 | PH3 |
分解温度/K | 873 | 773 | 1073 | T |
(1)CH4分解温度高于SiH4的原因是_________。
(2)仅依据元素非金属性强弱关系,预测PH3分解温度(T)的范围________;
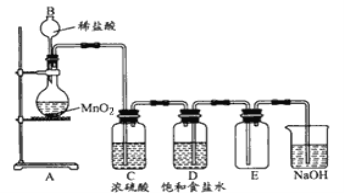
(3)某同学为证明非金属性![]() ,设计如图装置:
,设计如图装置:
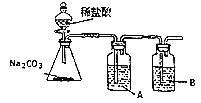
①A处盛放的试剂是__________;
②B中出现的现象是______;B处发生的离子反应方程式为_____________;
③该同学的设计中存在的问题是__________。