题目内容
下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是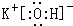
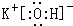 .
.
(3)最高价氧化物是两性氧化物的元素是
(4)用电子式表示元素④与⑥形成的化合物的形成过程: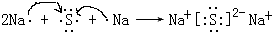
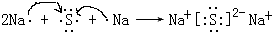 ,该化合物属于
,该化合物属于
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
Ar
Ar
(填具体元素符号,下同).(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是
HClO4
HClO4
,碱性最强的化合物的电子式是: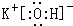
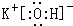
(3)最高价氧化物是两性氧化物的元素是
Al
Al
;写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2NaOH═2NaAlO2+H2O
Al2O3+2NaOH═2NaAlO2+H2O
.(4)用电子式表示元素④与⑥形成的化合物的形成过程:
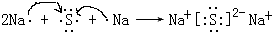
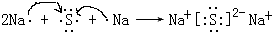
离子
离子
(填“共价”或“离子”)化合物.分析:(1)稀有气体化学性质稳定;
(2)同周期元素的原子,从左到右最高价氧化物对应水化物的酸性逐渐增强,碱性逐渐减弱,同主族元素的原子,从下到上最高价氧化物对应水化物的酸性逐渐增强,碱性逐渐减弱;
(3)最高价氧化物是两性氧化物的元素是Al,其氧化物与氢氧化钠反应生成盐和水;
(4)硫化钠是硫离子和钠离子之间通过离子键形成的离子化合物.
(2)同周期元素的原子,从左到右最高价氧化物对应水化物的酸性逐渐增强,碱性逐渐减弱,同主族元素的原子,从下到上最高价氧化物对应水化物的酸性逐渐增强,碱性逐渐减弱;
(3)最高价氧化物是两性氧化物的元素是Al,其氧化物与氢氧化钠反应生成盐和水;
(4)硫化钠是硫离子和钠离子之间通过离子键形成的离子化合物.
解答:解:由元素在周期表中的位置可知,①为C,②为N,③为O,④为Na,⑤为Al,⑥为S,⑦为Cl,⑧为Ar,⑨为K,
(1)上述元素中,最不活泼的为稀有气体Ar,
故答案为:Ar;
(2)最高价氧化物的水化物中,酸性最强的化合物的分子式为HClO4;碱性最强的化合物为KOH,其电子式是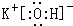 ,
,
故答案为:HClO4;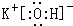 ;
;
(3)最高价氧化物是两性氧化物的元素是Al,其氧化物与氢氧化钠反应的化学方程式为Al2O3+2NaOH═2NaAlO2+H2O,
故答案为:Al;Al2O3+2NaOH═2NaAlO2+H2O;
(4)④与⑦的化合物为硫化钠,为离子化合物,其形成过程为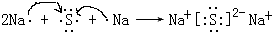 ,
,
故答案为: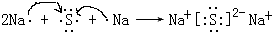 ;离子.
;离子.
(1)上述元素中,最不活泼的为稀有气体Ar,
故答案为:Ar;
(2)最高价氧化物的水化物中,酸性最强的化合物的分子式为HClO4;碱性最强的化合物为KOH,其电子式是
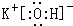 ,
,故答案为:HClO4;
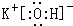 ;
;(3)最高价氧化物是两性氧化物的元素是Al,其氧化物与氢氧化钠反应的化学方程式为Al2O3+2NaOH═2NaAlO2+H2O,
故答案为:Al;Al2O3+2NaOH═2NaAlO2+H2O;
(4)④与⑦的化合物为硫化钠,为离子化合物,其形成过程为
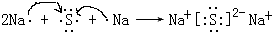 ,
,故答案为:
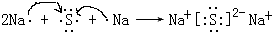 ;离子.
;离子.点评:本题考查元素周期表和元素周期律,明确元素的位置推断出各元素是解答的关键,熟悉元素及单质、化合物的性质即可解答,注意化学用语的应用,题目难度不大.

练习册系列答案
相关题目



 NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是
NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是 (4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是
(4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是