题目内容
【题目】高氯酸钾是一种白色粉末,可用作发烟剂、引火剂、氧化剂和化学分析试剂,医药工业用作解热和利尿等药剂。用PbO2来制备KClO4的工业流程如下:

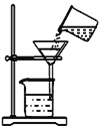
(1)如图过滤装置中有两处明显错误,一处是未用玻璃棒引流,另一处是__。
(2)写出NaClO3与PbO2反应的离子方程式_______________
(3)工业上可以利用滤液Ⅰ与KNO3发生反应制备KClO4的原因是______________
(4)用电解法也可以制备KClO4,在无隔膜、微酸性条件下,电解食盐水得到NaClO3溶液,再通过一系列转化和操作得到产品。
I.写出电解食盐水阳极电极反应式:______________________________
II.该过程制得的KClO4样品中含少量KCl杂质,为测定产品纯度进行如下实验:准确称取5.7635 g样品溶于水中,配成250 mL溶液,从中取出25.00 mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl-,反应为:
3KClO4+C6H12O6=6H2O+6CO2↑+3KCl,加入少量K2CrO4溶液作指示剂,用0.20mol·L-1AgNO3溶液滴定至终点,消耗AgNO3溶液体积21.50 mL。滴定达到终点时,产生砖红色Ag2CrO4沉淀。
①已知:Ksp(AgCl)=1.8×l0-10,Ksp(Ag2CrO4)=1.1×10-12,若终点时c(Cl-)=1.8×10-6 mol·L-1,则此时c(CrO42-)=______________mol·L-1。
②KClO4样品的纯度为______________。(精确到0.01%)
【答案】漏斗的下尖端没有紧靠接受的烧杯 PbO2+ClO3- +2H+ =Pb2++ClO4- +H2O KClO4的溶解度较小 Cl--6e-+3H2O = ClO3-+6H+ 1.1×10-4 96.12%
【解析】
(1)过滤操作时,为防止液体外溅,①要用玻璃棒引流;②漏斗末端应该紧靠烧杯内壁,所以如图过滤装置中有两处明显错误,一处是未用玻璃棒引流,另一处是漏斗的下尖端没有紧靠接受的烧杯。
(2)依据流程分析,在酸性溶液中,PbO2作氧化剂把NaClO3氧化为高氯酸钠,Pb元素由+4价降为+2价,反应的离子方程式为:PbO2+ClO3-+2H+=Pb2++ClO4-+H2O。
(3)因为KClO4的溶解度较小,滤液Ⅰ中含有ClO4-,加入硝酸钾,钾离子浓度增大,会析出KClO4晶体。
(4)I.微酸性条件下,电解食盐水得到NaClO3溶液,阳极发生氧化反应,Cl-失电子被氧化成ClO3-,因为在微酸性条件下反应,所以阳极电极反应式为:Cl--6e-+3H2O=ClO3-+6H+。
II.①滴定终点时c(Cl-)=1.8×10-6 molL-1,c(Ag+)=Ksp(AgCl)÷c(Cl-)=(1.8×l0-10÷1.8×10-6)molL-1=1.0×10-4molL-1,c(CrO42-)=Ksp(Ag2CrO4)÷c2(Ag+)=[1.1×10-12÷(1.0×10-4)2]molL-1=1.1×10-4molL-1。②n(AgNO3)=0.20mol·L-1×21.50mL×10-3LmL-1=0.0043mol,因为KClO4样品中含少量KCl杂质,所以n(KCl)总=n(AgCl)=n(AgNO3)=0.0043 mol,由氯原子守恒,样品中KClO4和KCl共0.0043mol,分别用n(KClO4)和n(KCl)含表示,则n(KClO4)+n(KCl)含=0.0043mol,又因为准确称取5.7635g样品溶于水中,配成250mL溶液,从中取出25.00mL进行实验,用于实验的样品质量为0.57635g,根据质量守恒,n(KClO4)×138.5gmol-1+n(KCl)含×74.5gmol-1=0.57635g,解得:n(KClO4)=0.0040mol,所以m(KClO4)=0.004mol×138.5gmol-1=0.554g,所以KClO4样品的纯度为:0.554g÷0.57635g×100%=96.12%(精确到0.01%)。

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案