题目内容
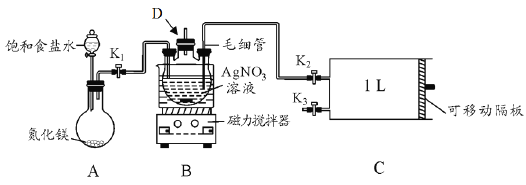
【题目】合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1)N2(g)+3H2(g)2NH3(g) △H<0,研究表明金属催化剂可加速氨气的合成。下表为某温度下等质量的不同金属分别催化合成氨气时,氢气的初始速率(mmol min-1)。
催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
①不同催化剂存在下,合成氨气反应的活化能最大的是_______ (填写催化剂的化学式)。
②某研究小组进一步探究催化剂对合成氨气的影响。将N2和H2以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NH3含量,如下图,从而确定温度对催化剂的影响。a点___ (填“是”或“不是”)对应温度下氨气平衡时的百分含量,说明其理由___。

(2)氨气的分解反应2NH3N2+3H2 △H<0,,在实际生产中往刚性容器中同时通入氨气和水蒸气,测得容器总压和氨气转化率随时间变化结果如图所示。
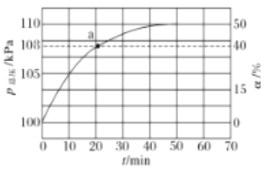
①平衡时,p(H2O)= ___kPa,平衡常数Kp=_____KPa2(Kp为以分压表示的平衡常数)。
②反应速率v=v正-v逆=K正p2(NH3)-K逆p(N2)p3(H2),k正、k逆分别为正、逆反应速率常数。计算a处的![]() =__。
=__。
(3)液氨中,2NH3(l)NH2-+NH4+,用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应______。
(4)在室温下用氨水吸收SO2。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的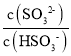 =____。(已知25℃,Kb(NH3H2O)=1.810-5;Ka1(H2SO3)=.310-2,Ka2(H2SO3)=6.210-8)
=____。(已知25℃,Kb(NH3H2O)=1.810-5;Ka1(H2SO3)=.310-2,Ka2(H2SO3)=6.210-8)
【答案】Fe 不是 该反应是放热反应,根据线Ⅱ可知,a点对应温度下的氨气的平衡体积分数会更高 80 168.75 8100 2NH3+2e-=H2+2NH2-或2NH4++2e-=H2↑+2NH3 0.62
【解析】
(1)①反应的活化能越高,则反应中活化分子数越少,反应速率越慢,则合成氨气反应的速率最慢的反应中,合成氨气反应的活化能最大,即当Fe作催化剂时活化能最大,
故答案为:Fe;
②该反应是放热反应,根据线Ⅱ可知,a点对应温度下的氨气的平衡体积分数会更高,a点不是对应温度下氨气平衡时的百分含量;
(2) ①反应开始总压强为100,反应达到平衡时增大为110,增大了10,说明氨气反应了10,由于氨气的转化率为50%,因此反应开始时氨气的含量为![]() =20%,故水蒸气占80%;p(H2O)=80kPa;根据上述分析可知:平衡时n(NH3)=20-10=10,n(N2)=5,n(H2)=15,则根据平衡常数的含义,物质的量的比等于气体的压强比,因此用平衡分压表示的平衡常数Kp=
=20%,故水蒸气占80%;p(H2O)=80kPa;根据上述分析可知:平衡时n(NH3)=20-10=10,n(N2)=5,n(H2)=15,则根据平衡常数的含义,物质的量的比等于气体的压强比,因此用平衡分压表示的平衡常数Kp=![]() =168.75;
=168.75;
②可逆反应2NH3N2+3H2达到平衡时,正反应速率与逆反应速率相等,此时氨气为10,氮气为5,氢气为15,v=v正-v逆=K正p2(NH3)-K逆p(N2)p3(H2),![]() =
=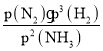 =
=![]() =168.75,在a点时压强为108,则说明此时氨气、氮气、氢气分别为12、4、12,所以
=168.75,在a点时压强为108,则说明此时氨气、氮气、氢气分别为12、4、12,所以![]() =
=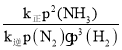 =
=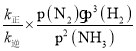 =
=![]() =8100;
=8100;
(3)阴极上氨气或铵根离子得电子发生还原反应,电极反应式为2NH3+2e-=H2+2NH2- 或2NH4++2e-=H2↑+2NH3;
(4)将含SO2的烟气通入该氨水中,当溶液显中性时,c(H+)=c(OH-)=10-7mol/L,Ka2(H2SO3)=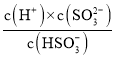 ,
,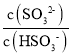 =
=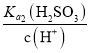 =
=![]() 。
。

【题目】元素周期表与元素周期律在学习、研究中有很重要的作用。下表是5种元素的相关信息,W、X都位于第三周期。
元素 | 信息 |
Q | 地壳中含量最高的元素 |
W | 最高化合价为+7价 |
X | 最高价氧化物对应的水化物在本周期中碱性最强 |
Y | 焰色试验(透过蓝色钴玻璃)火焰呈紫色 |
Z | 原子结构示意图为: |
(1)Q在周期表中的位置是__。
(2)W的最高价氧化物对应的水化物的化学式是___。
(3)X单质与水反应的离子方程式是__。
(4)金属性Y强于X,用原子结构解释原因:__,失电子能力Y大于X,金属性Y强于X。
(5)下列对于Z及其化合物的推断中,正确的是__(填字母)。
A.Z的最低负化合价与W的最低负化合价相同
B.Z的氢化物的稳定性弱于W的氢化物的稳定性
C.Z的单质可与X和W形成的化合物的水溶液发生置换反应