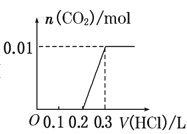
题目内容
【题目】酰苯胺作为一种常用药,具有解热镇痛的效果。实验室制备乙酰苯胺时,可以用苯胺与乙酸酐或与冰醋酸加热来制取,苯胺与乙酸酐的反应速率远大于与冰醋酸反应的速率,现选用苯胺与乙酸酐为原料制取和提纯乙酰苯胺,该放热反应的原理:

密度(g/mL) | 相对分子质量 | 颜色、状态 | 溶解性 | |
苯胺 | 1.04 | 93 | 无色油状液体 | 微溶于水, 易溶于乙醇、乙醚 |
乙酸酐 | 1.08 | 102 | 无色透明液体 | 遇水缓慢反应生成乙酸 |
乙酰苯胺 | 135 | 无色片状晶体, 熔点 114℃ | 不溶于冷水,可溶于热 水、乙醇、乙醚 |
实验步骤
①取5.00mL苯胺,倒入 100mL锥形瓶中,加入20mL水,在旋摇下分批加入 6.00mL 乙酸酐,搅拌均匀。若有结块现象产生,用玻璃棒将块状物研碎,再充分搅拌;
②反应完全后,及时把反应混合物转移到烧杯中,冷却后,抽滤,洗涤,得粗乙酰苯胺固体;
③将粗产品转移至 150mL 烧杯中,加入适量水配制成 80℃的饱和溶液,再加入过量 20%的水。稍冷后,加半匙活性炭,搅拌下将溶液煮沸 3~5min,趁热过滤,冷却结晶,抽滤、洗涤、晾干得乙酰苯胺纯品。
请回答:
(1)苯胺与冰醋酸反应制备乙酰苯胺的化学反应方程式______________________。
(2)反应温度过高会导致苯胺挥发,下列操作可控制反应温度,防止反应温度升高过快的是____________。
A.反应快结束时的充分搅拌 B.旋摇下分批加入 6.0mL 乙酸酐
C.玻璃棒将块状物研碎 D.加 20mL 水
(3)在步骤②中对粗产品进行洗涤可能需要用到以下操作:
a.加入洗涤剂至浸没固体;
b.洗涤剂缓慢通过;
c.洗涤剂快速通过;
d.关小水龙头;
e.开大水龙头;
f.重复 2~3 次。
请选出正确的操作并排序_____。(操作可重复使用)
(4)加入过量 20%的水的目的是_____。
(5)下列关于步骤③说法不正确的是__________________________。
A.活性炭吸附有色物质,可以提高产率
B.冷却时,冰水浴冷却比室温冷却更易得到大颗粒晶体便于抽滤
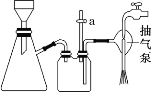
C.抽滤用如图装置,为防止倒吸,结束时可先关闭抽气泵,后打开活塞 a
D.洗涤完成后应将布氏漏斗从吸滤瓶上取下,左手握布氏漏斗,倒转,用右手“拍击”左手,使固体连同滤纸一起落入洁净的表面皿上,揭去滤纸,再对固体做晾干处理
【答案】![]() +CH3COOH
+CH3COOH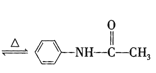 +H2O BD dabef 防止加热煮沸时,溶剂减少使产品析出导致产率降低 ABC
+H2O BD dabef 防止加热煮沸时,溶剂减少使产品析出导致产率降低 ABC
【解析】
(1)氨基和羧基反应依据羧脱羟基氨脱氢进行,所以苯胺与冰醋酸反应制备乙酰苯胺的化学反应方程式![]() ;
;
(2)A.反应快结束时的充分搅拌,溶液温度已经快速升高,A不符合题意;
B.旋摇下分批加入6.0mL乙酸酐,反应物浓度小,反应速率慢,可及时散热,不会造成温度过高,B符合题意;
C.玻璃棒将块状物研碎,增大接触面积,加快反应速率,放热快,会造成温度过高,C不符合题意;
D.加 20mL 水,降低浓度,反应速率慢,可及时散热,不会造成温度过高,D符合题意;
故答案选BD;
(3) 对粗产品进行洗涤的操作顺序为:先关闭小水龙头,加入洗涤剂至浸没固体,让洗涤剂缓慢通过,开大水龙头,重复 2~3 次,故答案为:dabef;
(4)加入过量 20%的水的目的是防止加热煮沸时,溶剂减少使产品析出导致产率降低;
(5)A.活性炭吸附有色物质,对反应没有影响,不能提高产率,A错误;
B.冰水浴冷却,温度下降快,晶体结晶快,晶体颗粒小,不便于抽滤,B错误;
C.为防止倒吸,结束时可先打开活塞 a,平衡压强,后关闭抽气泵,C错误;
D.洗涤完成后应将布氏漏斗从吸滤瓶上取下,左手握布氏漏斗,倒转,用右手“拍击”左手, 使固体连同滤纸一起落入洁净的表面皿上,揭去滤纸,再对固体做晾干处理,D正确。
答案选ABC。