题目内容
【题目】(10分)I、按要求书写热化学方程式:
(1)下图为N2(g)和02(g)生成NO(g)过程中的能量变化:

NO(g)分解生成N2(g)和O2(g)的热化学方程式为___________________;
(2)化合物AX3和单质X2在一定条件下反应可生成化合物AX5。己知AX3的熔点和沸点分别为为-93.6℃和76℃,AX5的熔点为167℃,室温时,AX3与气体X2反应生成1mol AX5,放出热量123.8kJ.该反应的热化学方程是为______.
II、已知单质硫在通常条件下以S8(斜方硫)的形式存在,而在蒸气状态时,含有S2、S4、S6及S8等多种同素异形体,其中S4、S6和S8具有相似的结构特点,其结构如下图所示:

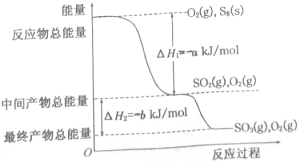
在一定条件下,S8(s)和O2(g)发生反应依次转化为S02(g)和S03(g)。反应过程和能量关系可用下图简单表示(图中的△H表示生成1mol产物的数据)。
(3)写出表示S8燃烧热的热化学方程式_________________。
(4)写出SO3分解生成SO2和O2的热化学方程式___________________。
(5)若已知S-O键的键能为dkJ/mol,O=O键的键能为ekJ/mol,则S8分子中S-S键的键能为_______kJ/mol。
【答案】(1)2NO(g)=N2(g)+O2(g) △H=-180kJ/mol ;(2)AX3(l)+X2(g)=AX5(s) △H=-123.8kJ/mol ;
(3)S8(s)+8O2(g)=8SO2(g) △H=-8akJ/mol ;(4) SO3(g)= SO2(g)+ 1/2O2(g) △H=+bkJ/mol ;
(5)2d—a—c
【解析】
试题分析:(1)根据图示可知生成NO的反应的反应热△H=断键吸收的能量-形成化学键放出的能量=946kJ/mol+498kJ/mol-2×632kJ/mol=-180kJ/mol,所以NO(g)分解生成N2(g)和O2(g)的热化学方程式为2NO(g)=N2(g)+O2(g) △H=-180kJ/mol;
(2)室温时,AX3与气体X2反应生成1mol AX5,放出热量123.8kJ,则该反应的热化学方程是为AX3(l)+X2(g)=AX5(s) △H=-123.8kJ/mol;
(3)根据图像可知S的燃烧热是akJ/mol,则表示S8燃烧热的热化学方程式为S8(s)+8O2(g)=8SO2(g) △H=-8akJ/mol。
(4)根据图像可知1molSO3分解生成SO2和O2吸收的能量是bkJ,则其热化学方程式为SO3(g)= SO2(g)+ 1/2O2(g) △H=+bkJ/mol。
(5)由于ΔH=反应物的化学键断裂吸收的能量-生成物的化学键形成释放的能量,所以根据(3)中分析可知8x+8e-8×2d=-8a,解得x=2d—a—c,即S8分子中S-S键的键能为(2d—a—c)kJ/mol。