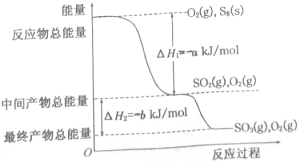
题目内容
【题目】二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为2S2Cl2+2H2O=SO2↑+3S↓+4HCl
.下列说法中错误的是

A.S2Cl2为含有极性键和非极性键的非极性分子
B.反应中SO2是氧化产物,S是还原产物
C.S2Cl2的分子构型与H2O2的分子构型相似
D.反应中,生成3molS,转移电子数目为3NA
【答案】A
【解析】
试题分析:A、由结构可知,S2Cl2分子中S原子之间形成1对共用电子对,Cl原子与S原子之间形成1对共用电子对,分子中S-S为非极性键,S-Cl键为极性键,S2Cl2是展开书页型结构,Cl-S位于两个书页面内,该物质结构不对称,正负电荷重心不重合,为极性分子,A错误;B、S2Cl2硫化合价由+1降低为0价硫,所以S为还原产物,S2Cl2硫化合价由+1升高为+4价SO2,所以SO2为氧化产物,B正确;C、根据结构图可知S S2Cl2的分子构型与H2O2的分子构型相似,C正确;D、在反应中,S元素发生自身氧化还原反应,S2Cl2硫化合价由+1升高为+4价SO2,所以生成1molSO2,转移电子为3mol,D正确;答案选A。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目