题目内容
【题目】
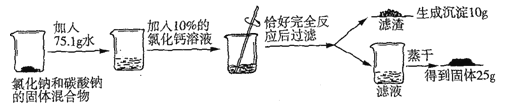
(1)写出上述反应的化学方程式_______________________;
(2)试列出求解混合物中碳酸钠的质量(x)的比例式_______________;
(3)原固体混合物中氯化钠的质量为_______________;
(4)反应后所得滤液中溶质的质量数为_______________;
(5)若工业上用此混合物239t与熟石灰混合制取含杂质的烧碱产品100t,则制得烧碱产品杂质含量为_______________。
【答案】(1)Na2CO3+CaCl2=CaCO3↓+2NaCl;(2)106:100=xg:10g;
(3)13.3g;(4)12.5%;(5)20%。
【解析】试题分析:(1)碳酸钠与氯化钙混合,发生反应:Na2CO3+CaCl2=CaCO3↓+2NaCl,产生白色沉淀;(2)根据方程式可知:每反应产生100份CaCO3沉淀,会反应消耗106份Na2CO3,所以混合物中碳酸钠的质量(x)的比例式是106:100=xg:10g; (3) 根据混合物中碳酸钠的质量(x)的比例式是106:100=xg:10g,可知原混合物中含有碳酸钠的质量是10.6g,根据方程式Na2CO3+CaCl2=CaCO3↓+2NaCl可知:每反应产生100份的CaCO3,同时会产生117份的NaCl,则发生上述反应产生的NaCl的质量是(117÷100)×10g=11.7g,所以原固体混合物中氯化钠的质量为25g-11.7g=13.3g;(4)原固体的质量是m="10.6g" +3.3g=13.9g,加入水的质量是75.1g,反应析出CaCO3质量是10g,由于CaCl2溶液的质量分数是10%,根据钙元素守恒可知加入CaCl2的质量是m(CaCl2)=0.1mol×111g/mol÷10%=111g;反应后溶液的质量是m=111g+75.1g+10.6g+13.3g10g =200g,溶质NaCl的质量是25g,所以反应后所得滤液中溶质的质量分数为:(25g÷200g)×100%=12.5%;(5) 设生成氢氧化钠的质量为m,
Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH
106 80
![]() m
m
106:![]() =80:m,解得m=80t,
=80:m,解得m=80t,
所以制得烧碱产品杂质含量为:[(100t80t)÷100t]×100%=20%。

 名校课堂系列答案
名校课堂系列答案