题目内容
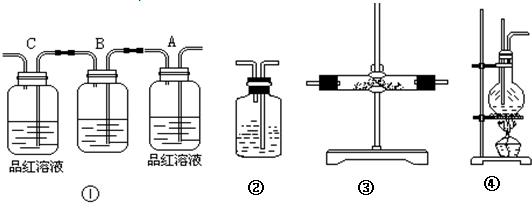
(1)装置③中的固体药品为______,用以验证的产物是______
(2)装置B中的试剂为______(填“A、B、C、D”)
A.溴水 B.酸性高锰酸钾溶液 C.NaOH溶液 D.饱和NaHCO3溶液
(3)装置②盛有______,可以验证______气体的存在.
(4)用装置的编号表示其连接顺序(按气体产物从左到右的流向) ④→______;
(5)装置A中的现象是______,验证______;
(6)装置C中的现象是______说明______.
(1)因装置③用来检验水蒸气检,所用试剂为无水硫酸铜,故答案为:无水硫酸铜;水蒸气;
(2)因装置①用来检验SO2,A瓶品红溶液褪色,说明含有SO2,B瓶装有溴水除去SO2,C瓶通过品红溶液不褪色确认SO2已除干净,故答案为:A;
(3)因装置②用来检验二氧化碳,二氧化碳能使澄清石灰水变浑浊,故答案为:澄清石灰水;CO2;
(4)因先发生反应产生混合气体,然后依次检验水蒸气、接着检验二氧化硫,最后检验二氧化碳,所以用装置的编号表示其连接顺序(按气体产物从左到右的流向)④③①②,故答案为:③①②;
(5)因装置①用来检验SO2,A瓶品红溶液褪色,说明含有SO2,B瓶装有溴水除去SO2,C瓶通过品红溶液不褪色确认SO2已除干净,故答案为:品红褪色;SO2;
(6)因装置①用来检验SO2,A瓶品红溶液褪色,说明含有SO2,B瓶装有溴水除去SO2,C瓶通过品红溶液不褪色确认SO2已除干净,故答案为:品红不褪色;SO2已被除净.

 阅读快车系列答案
阅读快车系列答案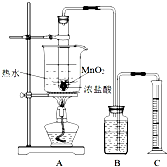 实验室常用浓盐酸与二氧化锰反应制取氯气.浓盐酸和二氧化锰反应过程中,浓盐酸的浓度不断降低,当盐酸浓度降至临界浓度时,反应停止.
实验室常用浓盐酸与二氧化锰反应制取氯气.浓盐酸和二氧化锰反应过程中,浓盐酸的浓度不断降低,当盐酸浓度降至临界浓度时,反应停止.方法一:
甲同学利用图装置,测定盐酸浓度降至临界浓度时 反应生成氯气的体积,来探究在某温度下浓盐酸与二氧化锰反应的临界浓度.
方法:A中试管有足量的MnO2,往其中加入10mol/L的浓盐酸,控制温度为80℃进行反应.甲同学进行了三次同样的实验,收集气体(体积均换算成标准状况),数据如下表:
| 第一次实验 | 第二次实验 | 第三次实验 | |
| 盐酸的用量 | 10.0mL | 10.0mL | 10.0mL |
| 氯气的体积 | 225mL | 192mL | 223mL |
(1)请写出A中试管内反应的离子方程式
(2)检验该装置的气密性的方法是
(3)B中加入的溶液为
(4)为计算与二氧化锰反应的浓盐酸临界浓度,甲同学的第
方法二:
(5)乙同学认为该实验有不足之处:浓盐酸易挥发,会造成上述所测的临界浓度
乙同学提出可直接用反应后A中的溶液来测定盐酸的临界浓度:
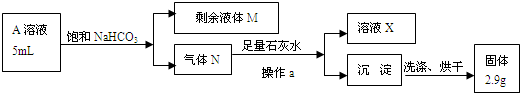
(6)以上图表中操作a的名称是
(7)请写出A溶液中的物质与NaHCO3溶液反应的离子方程式:
(8)根据以上数据,浓盐酸与二氧化锰制氯气的反应中浓盐酸的临界浓度为
化学是以实验为基础的学科,化学实验又有定性实验和定量实验之分。利用已学知识对下列实验进行分析并填空:
Ⅰ.
实验



实验结论 结论:
FeCl3在实验中的作用为:
反应方程式
II.
资料:氯气难溶于饱和氯化钠溶液;实验室可利用MnO2和浓盐酸在加热的条件下制备氯气
实验:某食盐样品中混有NaBr杂质,为测定该食盐样品的纯度,设计实验过程如甲图所示:

阅读上述资料和实验过程,完成下列填空:
(1)请从下方乙图中选出四个装置(可重复使用),来完成制取并向溶液A中通入过量Cl2的实验,将所选装置的选项代码填入方框,并在括号中写出装置内所放的化学药品。


(2)为了证明甲图中溶液D中几乎不存在Br-,可选用的试剂为 (填选项字母)
A. 碘水 B. 淀粉碘化钾溶液
C. 新制氯水和四氯化碳 D. 食盐水
(3)依据甲图所示,在萃取操作中应选取的有机溶剂为
A. 四氯化碳 B. 水 C. 乙醇 D. 苯
(4)在萃取、分液的过程中,把分液漏斗玻璃塞上的凹槽对准漏斗口上的小孔,其目的是
(5)试计算原固体混合物中氯化钠的质量分数为 %