题目内容
化学是以实验为基础的学科,化学实验又有定性实验和定量实验之分。利用已学知识对下列实验进行分析并填空:
Ⅰ.
实验



实验结论 结论:
FeCl3在实验中的作用为:
反应方程式
II.
资料:氯气难溶于饱和氯化钠溶液;实验室可利用MnO2和浓盐酸在加热的条件下制备氯气
实验:某食盐样品中混有NaBr杂质,为测定该食盐样品的纯度,设计实验过程如甲图所示:

阅读上述资料和实验过程,完成下列填空:
(1)请从下方乙图中选出四个装置(可重复使用),来完成制取并向溶液A中通入过量Cl2的实验,将所选装置的选项代码填入方框,并在括号中写出装置内所放的化学药品。


(2)为了证明甲图中溶液D中几乎不存在Br-,可选用的试剂为 (填选项字母)
A. 碘水 B. 淀粉碘化钾溶液
C. 新制氯水和四氯化碳 D. 食盐水
(3)依据甲图所示,在萃取操作中应选取的有机溶剂为
A. 四氯化碳 B. 水 C. 乙醇 D. 苯
(4)在萃取、分液的过程中,把分液漏斗玻璃塞上的凹槽对准漏斗口上的小孔,其目的是
(5)试计算原固体混合物中氯化钠的质量分数为 %
Ⅰ. 实验目的:探究温度对H2O2分解反应速率的影响
温度越高,化学反应速率越快 催化剂 (或加快反应速率)2H2O2  2H2O + O2 ↑
2H2O + O2 ↑
Ⅱ. (1)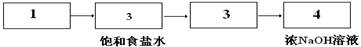
(2)C(3)D(4)内外气压相通,使分液漏斗内液体能够顺利流下。(5)92.4%
【解析】Ⅰ.根据实验装置图及试剂可知,目的是检验探究温度对H2O2分解反应速率的影响。根据实验现象可知,温度越高,反应速率越快。在该反应中氯化铁起催化剂的作用,方程式为2H2O2  2H2O + O2 ↑。
2H2O + O2 ↑。
Ⅱ. (1)生成的氯气中含有氯化氢气体,所以需要利用饱和食盐水除去氯化氢。氯气有毒,所以尾气处理,用氢氧化钠吸收氯气。
(2)如果含有溴离子,在可利用氯水的氧化性把溴离子氧化生成单质溴,然后利用四氯化碳除去即可,答案选C。
(3)水和乙醇不能用作萃取剂,根据图可知,上层是有机层,说明萃取剂的密度小于水的,所以答案选D。
(4)这样做的目的是内外气压相通,使分液漏斗内液体能够顺利流下。
(5)反应的方程式为 Cl2 + 2NaBr=Br2 + 2NaCl
206g 117g
m (88g-84.2g)=3.8g
所以m=6.7g
则氯化钠的质量是88g-6.7g=81.3g
所以质量分数为81.3÷88×100%=92.4%

| A、制氧气时排水法收集氧气后出现倒吸现象,立即松开试管上的橡皮塞 | B、在气体发生装置上直接点燃乙炔气体时,必须先检验乙炔气体的纯度 | C、实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室 | D、给试管中的液体加热时不停移动试管或加入碎瓷片,以免暴沸伤人 |




