题目内容
化学是以实验为基础的学科,化学实验又有定性实验和定量实验之分.利用已学知识对下列实验进行分析并填空:
Ⅰ.
Ⅱ.
Ⅲ.
资料:氯气难溶于饱和氯化钠溶液;实验室可利用MnO2和浓盐酸在加热的条件下制备氯气
实验:某食盐样品中混有NaBr杂质,为测定该食盐样品的纯度,设计实验过程如甲图所示:

阅读上述资料和实验过程,完成下列填空:
(1)请从乙图中选出四个装置(可重复使用),来完成制取并向溶液A中通入过量Cl2的实验,将所选装置的选项代码填入方框,并在括号中写出装置内所放的化学药品.

(2)为了证明甲图中溶液D中几乎不存在Br-,可选用的试剂为
A.碘水
B.淀粉碘化钾溶液
C.新制氯水和四氯化碳
D.食盐水
(3)依据甲图所示,在萃取操作中应选取的有机溶剂为
A.四氯化碳 B.水 C.乙醇 D.苯
(4)在萃取、分液的过程中,把分液漏斗玻璃塞上的凹槽对准漏斗口上的小孔,其目的是
(5)试计算原固体混合物中氯化钠的质量分数为
Ⅰ.
| 实验目的 | 探究温度对H2O2分解反应速率的影响 探究温度对H2O2分解反应速率的影响 | ||||||||||
实验 |
 |
 |
 | ||||||||
| 实验结论 | 结论: 温度越高,反应速率越快 温度越高,反应速率越快 FeCl3在实验中的作用为: 催化剂 催化剂 | ||||||||||
| 反应方程式 | 2H2O2
2H2O2
| ||||||||||
| 实验目的 | 探究卤素单质氧化性的相对强弱 | |
| 实验 | 现象 | 离子方程式 |
| 1.将少量氯水分别加入盛有KBr和NaI溶液的试管中, 振荡后加入CCl4,振荡、静置 |
(1)溶液分层,上层几 乎无色,下层为橙色. (2) 溶液分层,上层几乎无色,下层为紫(红)色 溶液分层,上层几乎无色,下层为紫(红)色 |
(1) Cl2+2Br-=Br2+2Cl- Cl2+2Br-=Br2+2Cl- (2) Cl2+2I-=I2+2Cl- Cl2+2I-=I2+2Cl- |
| 2.将少量溴水加入盛有NaI溶液的试管中, 振荡后加入少量CCl4,振荡、静置 |
/ | (3) Br2+2I-=I2+2Br- Br2+2I-=I2+2Br- |
| 实验结论并从原子结构上解释原因 | 结论:氧化性:Cl2>Br2>I2 解释原因:同主族元素从上到下,核电荷数逐渐增大,电子层数逐渐增多,原子半径逐渐增大,原子核对外层电子的引力逐渐减弱,单质的氧化性逐渐减弱 结论:氧化性:Cl2>Br2>I2 解释原因:同主族元素从上到下,核电荷数逐渐增大,电子层数逐渐增多,原子半径逐渐增大,原子核对外层电子的引力逐渐减弱,单质的氧化性逐渐减弱 | |
资料:氯气难溶于饱和氯化钠溶液;实验室可利用MnO2和浓盐酸在加热的条件下制备氯气
实验:某食盐样品中混有NaBr杂质,为测定该食盐样品的纯度,设计实验过程如甲图所示:

阅读上述资料和实验过程,完成下列填空:
(1)请从乙图中选出四个装置(可重复使用),来完成制取并向溶液A中通入过量Cl2的实验,将所选装置的选项代码填入方框,并在括号中写出装置内所放的化学药品.

(2)为了证明甲图中溶液D中几乎不存在Br-,可选用的试剂为
C
C
(填选项字母).A.碘水
B.淀粉碘化钾溶液
C.新制氯水和四氯化碳
D.食盐水
(3)依据甲图所示,在萃取操作中应选取的有机溶剂为
D
D
.A.四氯化碳 B.水 C.乙醇 D.苯
(4)在萃取、分液的过程中,把分液漏斗玻璃塞上的凹槽对准漏斗口上的小孔,其目的是
内外气压相通,使分液漏斗内液体能够顺利流下
内外气压相通,使分液漏斗内液体能够顺利流下
.(5)试计算原固体混合物中氯化钠的质量分数为
90
90
%.分析:I.根据各个实验的不同点确定实验目的;氯化铁有催化作用;双氧水在催化剂作用下立即分解生成水和氧气;
II.碘在水溶液里呈紫色;氯气能和溴离子、碘离子发生氧化还原反应生成溴、碘;溴能氧化碘离子生成碘;根据同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性分析;
III.(1)根据气体制取装置→除杂装置→吸收装置→尾气处理装置排序;
(2)氯气能和溴离子发生氧化还原反应生成溴单质,溴水呈橙色;
(3)溶质在萃取剂中的溶解度大于在水中的溶解度、萃取剂和原溶剂不互溶、萃取剂和溶质不反应;
(4)利用压强差使液体流下;
(5)根据固体质量差计算样品中氯化钠的质量,再根据质量分数公式计算其质量分数.
II.碘在水溶液里呈紫色;氯气能和溴离子、碘离子发生氧化还原反应生成溴、碘;溴能氧化碘离子生成碘;根据同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性分析;
III.(1)根据气体制取装置→除杂装置→吸收装置→尾气处理装置排序;
(2)氯气能和溴离子发生氧化还原反应生成溴单质,溴水呈橙色;
(3)溶质在萃取剂中的溶解度大于在水中的溶解度、萃取剂和原溶剂不互溶、萃取剂和溶质不反应;
(4)利用压强差使液体流下;
(5)根据固体质量差计算样品中氯化钠的质量,再根据质量分数公式计算其质量分数.
解答:解:Ⅰ.根据图中,三个实验的不同点是温度不同,所以其实验目的是:探究温度对双氧水分解反应速率的影响;
实验结论:温度越高,反应速率越快,说明温度升高促进其分解;氯化铁在反应中作催化剂,起催化作用;
双氧水在氯化铁作催化剂条件下分解生成水和氧气,所以其反应方程式为:2H2O2
2H2O+O2↑,
故答案为:
Ⅱ.氯气和碘离子反应生成碘,碘易溶于四氯化碳导致其溶液呈紫色,四氯化碳密度大于水且和水不互溶,所以看到的现象是:溶液分层,上层几乎无色,下层为紫(红)色;
通过实验现象知,氯气和溴离子发生氧化还原反应生成溴单质,离子反应方程式为:Cl2+2Br-=Br2+2Cl-
氯气和碘离子发生氧化还原反应生成碘单质,离子反应方程式为Cl2+2I-=I2+2Cl-,
溴和碘离子发生氧化还原反应生成碘单质,离子反应方程式为Br2+2I-=I2+2Br-,
解释原因:根据同一自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,所以氧化性:Cl2>Br2>I2,
这几种元素都是同一主族元素,同主族元素从上到下,核电荷数逐渐增大,电子层数逐渐增多,原子半径逐渐增大,原子核对外层电子的引力逐渐减弱,导致单质的氧化性逐渐减弱,其阴离子的还原性逐渐增强,
故答案为:
Ⅲ.(1)根据气体制取装置→除杂装置→吸收装置→尾气处理装置排序,用二氧化锰和浓盐酸需要加热制取氯气,故选1;
盐酸具有挥发性,加热条件下促进其挥发,所以制取的氯气中含有氯化氢,氯化氢极易溶于水,饱和食盐水中含有氯离子抑制氯气溶解,所以可以用排饱和食盐水方法除杂,故选3;
溶液和氯气反应,故选3;
氯气有毒不能直接排空,要用氢氧化钠溶液吸收尾气,故选4;
故答案为: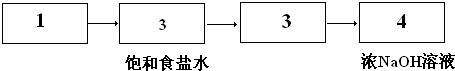 ;
;
(2)氯气能和溴离子发生氧化还原反应生成溴单质,溴水呈橙色,故选C;
(3)溶质在萃取剂中的溶解度大于在水中的溶解度、萃取剂和原溶剂不互溶、萃取剂和溶质不反应,根据题意知,萃取剂位于水的上层,则其密度小于水,
A.四氯化碳具备萃取剂特点,但密度大于水,故错误;
B.水和原溶剂相同,故错误;
C.乙醇和水互溶,故错误;
D.苯具备萃取剂的特点,且密度小于水,故正确;
故选D;
(4)利用压强差使液体流下,分液漏斗玻璃塞上的凹槽对准漏斗口上的小孔时内外气压相通,使分液漏斗内液体能够顺利流下,故答案为:内外气压相通,使分液漏斗内液体能够顺利流下;
(5)样品质量是88.0g,溴化钠和氯气反应生成氯化钠和溴,加热过程中,溴挥发,所以剩余固体是氯化钠,
设样品中氯化钠的质量为xg,则溴化钠的质量=(88.0-x)g,
2NaBr+Cl2=Br2+2NaCl 固体质量差
206g 89g
(88.0-x)g (88.0-84.2)g
=
,x=79.2,
氯化钠的质量分数=
×100%=90%,
故答案为:90.
实验结论:温度越高,反应速率越快,说明温度升高促进其分解;氯化铁在反应中作催化剂,起催化作用;
双氧水在氯化铁作催化剂条件下分解生成水和氧气,所以其反应方程式为:2H2O2
| ||
故答案为:
| 实验目的:探究温度对H2O2分解反应速率的影响 | ||||
| 温度越高,化学反应速率越快 催化剂 (或加快反应速率) | ||||
2H2O2
|
通过实验现象知,氯气和溴离子发生氧化还原反应生成溴单质,离子反应方程式为:Cl2+2Br-=Br2+2Cl-
氯气和碘离子发生氧化还原反应生成碘单质,离子反应方程式为Cl2+2I-=I2+2Cl-,
溴和碘离子发生氧化还原反应生成碘单质,离子反应方程式为Br2+2I-=I2+2Br-,
解释原因:根据同一自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,所以氧化性:Cl2>Br2>I2,
这几种元素都是同一主族元素,同主族元素从上到下,核电荷数逐渐增大,电子层数逐渐增多,原子半径逐渐增大,原子核对外层电子的引力逐渐减弱,导致单质的氧化性逐渐减弱,其阴离子的还原性逐渐增强,
故答案为:
| (2)溶液分层,上层几乎无色,下层为紫(红)色 | (1)Cl2+2Br-=Br2+2Cl- (2)Cl2+2I-=I2+2Cl- |
| (3)Br2+2I-=I2+2Br- | |
| 结论:氧化性:Cl2>Br2>I2 解释原因:同主族元素从上到下,核电荷数逐渐增大,电子层数逐渐增多,原子半径逐渐增大,原子核对外层电子的引力逐渐减弱,单质的氧化性逐渐减弱. | |
盐酸具有挥发性,加热条件下促进其挥发,所以制取的氯气中含有氯化氢,氯化氢极易溶于水,饱和食盐水中含有氯离子抑制氯气溶解,所以可以用排饱和食盐水方法除杂,故选3;
溶液和氯气反应,故选3;
氯气有毒不能直接排空,要用氢氧化钠溶液吸收尾气,故选4;
故答案为:
 ;
;(2)氯气能和溴离子发生氧化还原反应生成溴单质,溴水呈橙色,故选C;
(3)溶质在萃取剂中的溶解度大于在水中的溶解度、萃取剂和原溶剂不互溶、萃取剂和溶质不反应,根据题意知,萃取剂位于水的上层,则其密度小于水,
A.四氯化碳具备萃取剂特点,但密度大于水,故错误;
B.水和原溶剂相同,故错误;
C.乙醇和水互溶,故错误;
D.苯具备萃取剂的特点,且密度小于水,故正确;
故选D;
(4)利用压强差使液体流下,分液漏斗玻璃塞上的凹槽对准漏斗口上的小孔时内外气压相通,使分液漏斗内液体能够顺利流下,故答案为:内外气压相通,使分液漏斗内液体能够顺利流下;
(5)样品质量是88.0g,溴化钠和氯气反应生成氯化钠和溴,加热过程中,溴挥发,所以剩余固体是氯化钠,
设样品中氯化钠的质量为xg,则溴化钠的质量=(88.0-x)g,
2NaBr+Cl2=Br2+2NaCl 固体质量差
206g 89g
(88.0-x)g (88.0-84.2)g
| 206 |
| 88.0-x |
| 89 |
| 88.0-84.2 |
氯化钠的质量分数=
| 79.2g |
| 88.0g |
故答案为:90.
点评:本题考查较综合,涉及氯气的实验室制法、物质间的置换反应等知识点,难点是实验仪器的选取和排序,根据“制取装置→除杂装置→吸收装置→尾气处理装置”对实验仪器进行排序,注意萃取剂的选取方法,难度中等.

练习册系列答案
相关题目
化学是以实验为基础的学科,化学实验设计和操作中必须十分重视师生的安全问题和环境保护问题.下列操作方法不正确的是( )
| A、制氧气时排水法收集氧气后出现倒吸现象,立即松开试管上的橡皮塞 | B、在气体发生装置上直接点燃乙炔气体时,必须先检验乙炔气体的纯度 | C、实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室 | D、给试管中的液体加热时不停移动试管或加入碎瓷片,以免暴沸伤人 |