题目内容
随着环保意识的增强,清洁能源越来越受人们关注.
(1)氢能在二十一世纪有可能在世界能源舞台上成为一种举足轻重的二次能源.
①硫-碘循环分解水制氢主要涉及下列反应:
I.SO2+2H2O+I2=H2SO4+2HIⅡ.2HI
H2+I2Ⅲ.2H2SO4=2SO2+O2+2H2O
分析上述反应,下列判断正确的是
a.反应Ⅲ易在常温下进行 b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程中产生l mol O2的同时产生1mol H2
②利用甲烷与水反应制备氢气,因原料价廉产氢率高,具有实用推广价值,已知该反应为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ?mol-1若800℃时,反应的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=3.0mol?L-1;c(H2O)=8.5mol?L-1;c(CO)=2.0mol?L-1;c(H2)=2.0mol?L-1,则此时正逆反应速率的关系是v正
③实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)
CH3OH(g)分析该反应并回答下列问题:
①下列各项中,不能说明该反应已达到平衡的是
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗1mol CO,同时生成l mol CH3OH
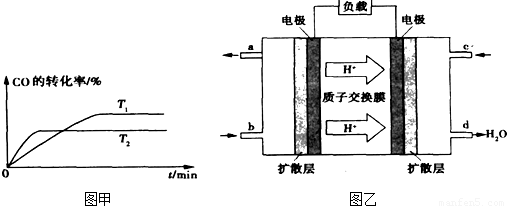
②如图甲是该反应在不同温度下CO的转化率随时间变化的曲线.T1和T2温度下的平衡常数大小关系是K1
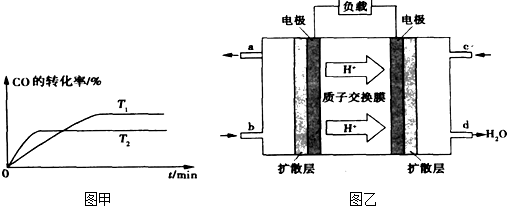
③已知甲醇燃料电池的工作原理如图乙所示.
①该电池工作时,b口通入的物质为
(1)氢能在二十一世纪有可能在世界能源舞台上成为一种举足轻重的二次能源.
①硫-碘循环分解水制氢主要涉及下列反应:
I.SO2+2H2O+I2=H2SO4+2HIⅡ.2HI
| 通电 |
分析上述反应,下列判断正确的是
c
c
(填序号,下同).a.反应Ⅲ易在常温下进行 b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程中产生l mol O2的同时产生1mol H2
②利用甲烷与水反应制备氢气,因原料价廉产氢率高,具有实用推广价值,已知该反应为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ?mol-1若800℃时,反应的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=3.0mol?L-1;c(H2O)=8.5mol?L-1;c(CO)=2.0mol?L-1;c(H2)=2.0mol?L-1,则此时正逆反应速率的关系是v正
>
>
v逆.(填“>”、“<”或“=”)③实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡
向右
向右
移动(填“向左”、“向右”或“不”);若加入少量下列固体试剂中的b
b
,产生H2的速率将增大.a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)
| 加热 |
①下列各项中,不能说明该反应已达到平衡的是
d
d
.a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗1mol CO,同时生成l mol CH3OH
②如图甲是该反应在不同温度下CO的转化率随时间变化的曲线.T1和T2温度下的平衡常数大小关系是K1
>
>
K2.(填“>”、“<”或“=”)③已知甲醇燃料电池的工作原理如图乙所示.

①该电池工作时,b口通入的物质为
CH3OH
CH3OH
,该电池正极的电极反应式为:O2+4e-+4H+=2H2O
O2+4e-+4H+=2H2O
,工作一段时间后,当6.4g甲醇(CH3OH)完全反应生成CO2时,有1.2
1.2
mol电子发生转移.分析:(1)①a.硫酸常温下温度,不易分解.
b.反应中二氧化硫表现还原性,氧化性比HI强.
c.1molSO2消耗2molH2O生成1molH2SO4,1molH2SO4分解生成1molSO2与1molH2O.
d.由Ⅲ可知产生lmolO2的同时产生2molSO2,由I可知2molSO2生成4molHI,由Ⅱ可知4molHI分解生成2mol H2.
②计算该浓度下的溶度积Qc,与平衡常数k=1比较,若Qc=1,处于平衡状态,若Qc>1,平衡向逆反应移动,若Qc<1,向正反应移动.
③实验室用Zn和稀硫酸制取H2,随反应进行溶液中氢离子浓度降低,水的电离平衡增大;增大氢离子的浓度、加热、形成原电池等可以加快反应速率.
(2)化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变.
a.恒温、恒容条件下,随反应进行反应混合物的物质的量减小,体系压强减小,容器内的压强不发生变化,说明到达平衡.
b.CH3OH分解的速率和CH3OH生成的速率相等,正逆反应速率相等,反应达平衡状态.
c.各物质的浓度不变,说明到达平衡状态.
d.单位时间内消耗1mol CO,同时生成l mol CH3OH,都表示正反应速率,自始至终都按1:1进行.
②温度越高反应速率越快,到达平衡时间越短,故T1<T2,温度越高CO的转化率越小,升高温度平衡向逆反应移动.
③由质子的定向移动可知左侧电极为燃料电池的负极,右侧电极为燃料电池的正极,负极发生氧化反应,甲醇在负极放电,正极反应还原反应,氧气在正极放电,负极电极反应式为
CH3OH(l)+H2O(l)-6e-=CO2(g)+6H+,正极反应式为O2+4e-+4H+=2H2O.6.4g甲醇(CH3OH)的物质的量为
=0.2mol,根据电极反应式计算转移电子的物质的量.
b.反应中二氧化硫表现还原性,氧化性比HI强.
c.1molSO2消耗2molH2O生成1molH2SO4,1molH2SO4分解生成1molSO2与1molH2O.
d.由Ⅲ可知产生lmolO2的同时产生2molSO2,由I可知2molSO2生成4molHI,由Ⅱ可知4molHI分解生成2mol H2.
②计算该浓度下的溶度积Qc,与平衡常数k=1比较,若Qc=1,处于平衡状态,若Qc>1,平衡向逆反应移动,若Qc<1,向正反应移动.
③实验室用Zn和稀硫酸制取H2,随反应进行溶液中氢离子浓度降低,水的电离平衡增大;增大氢离子的浓度、加热、形成原电池等可以加快反应速率.
(2)化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变.
a.恒温、恒容条件下,随反应进行反应混合物的物质的量减小,体系压强减小,容器内的压强不发生变化,说明到达平衡.
b.CH3OH分解的速率和CH3OH生成的速率相等,正逆反应速率相等,反应达平衡状态.
c.各物质的浓度不变,说明到达平衡状态.
d.单位时间内消耗1mol CO,同时生成l mol CH3OH,都表示正反应速率,自始至终都按1:1进行.
②温度越高反应速率越快,到达平衡时间越短,故T1<T2,温度越高CO的转化率越小,升高温度平衡向逆反应移动.
③由质子的定向移动可知左侧电极为燃料电池的负极,右侧电极为燃料电池的正极,负极发生氧化反应,甲醇在负极放电,正极反应还原反应,氧气在正极放电,负极电极反应式为
CH3OH(l)+H2O(l)-6e-=CO2(g)+6H+,正极反应式为O2+4e-+4H+=2H2O.6.4g甲醇(CH3OH)的物质的量为
| 6.4g |
| 32g/mol |
解答:解:(1)①a.硫酸常温下温度,不易分解,故a错误;
b.反应中二氧化硫表现还原性,氧化性比HI强,故b错误;
c.1molSO2消耗2molH2O生成1molH2SO4,1molH2SO4分解生成1molSO2与1molH2O,循环中水的量减少,故应补充水,故c正确;
d.由Ⅲ可知产生lmolO2的同时产生2molSO2,由I可知2molSO2生成4molHI,由Ⅱ可知4molHI分解生成2mol H2,即循环过程中产生l mol O2的同时产生2mol H2,故d错误;
故选:c;
②浓度商Qc=
=0.6<1,所以平衡向正反应移动,即v正>v逆,故选:>;
③实验室用Zn和稀硫酸制取H2,随反应进行溶液中氢离子浓度降低,水的电离平衡增大,向右移动;
a.加入NaNO3,氢离子浓度不变,不能增大氢气的生成速率,故a错误;
b.加入CuSO4,形成原电池,加快氢气的生成速率,故b正确;
c.加入Na2SO4,氢离子浓度不变,不能增大氢气的生成速率,故c错误;
d.加入NaHSO3,与氢离子反应,氢离子浓度降低,氢气的生成速率降低,故d错误;
故答案为:向右;b;
(2)化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变.
a.恒温、恒容条件下,随反应进行反应混合物的物质的量减小,体系压强减小,容器内的压强不发生变化,说明到达平衡,故a正确;
b.CH3OH分解的速率和CH3OH生成的速率相等,正逆反应速率相等,反应达平衡状态,故b正确;
c.CO、H2和CH3OH的浓度保持不变,说明到达平衡状态,故c正确;
d.单位时间内消耗1mol CO,同时生成l mol CH3OH,都表示正反应速率,自始至终都按1:1进行,故d错误;
故选:d;
②温度越高反应速率越快,到达平衡时间越短,故T1<T2,温度越高CO的转化率越小,升高温度平衡向逆反应移动,温度平衡常数降低,温度越高平衡常数越小,即K1>K2,
故答案为:>;
③由质子的定向移动可知左侧电极为燃料电池的负极,右侧电极为燃料电池的正极,负极发生氧化反应,甲醇在负极放电,故b通入CH3OH;正极反应还原反应,氧气在正极放电,正极反应式为O2+4e-+4H+=2H2O;6.4g甲醇(CH3OH)的物质的量为
=0.2mol,由负极电极反应式为CH3OH+H2O-6e-=CO2+6H+可知转移电子的物质的量为0.2mol×6=1.2mol,
故答案为:CH3OH;O2+4e-+4H+=2H2O;1.2.
b.反应中二氧化硫表现还原性,氧化性比HI强,故b错误;
c.1molSO2消耗2molH2O生成1molH2SO4,1molH2SO4分解生成1molSO2与1molH2O,循环中水的量减少,故应补充水,故c正确;
d.由Ⅲ可知产生lmolO2的同时产生2molSO2,由I可知2molSO2生成4molHI,由Ⅱ可知4molHI分解生成2mol H2,即循环过程中产生l mol O2的同时产生2mol H2,故d错误;
故选:c;
②浓度商Qc=
| 23×2 |
| 3×8.5 |
③实验室用Zn和稀硫酸制取H2,随反应进行溶液中氢离子浓度降低,水的电离平衡增大,向右移动;
a.加入NaNO3,氢离子浓度不变,不能增大氢气的生成速率,故a错误;
b.加入CuSO4,形成原电池,加快氢气的生成速率,故b正确;
c.加入Na2SO4,氢离子浓度不变,不能增大氢气的生成速率,故c错误;
d.加入NaHSO3,与氢离子反应,氢离子浓度降低,氢气的生成速率降低,故d错误;
故答案为:向右;b;
(2)化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变.
a.恒温、恒容条件下,随反应进行反应混合物的物质的量减小,体系压强减小,容器内的压强不发生变化,说明到达平衡,故a正确;
b.CH3OH分解的速率和CH3OH生成的速率相等,正逆反应速率相等,反应达平衡状态,故b正确;
c.CO、H2和CH3OH的浓度保持不变,说明到达平衡状态,故c正确;
d.单位时间内消耗1mol CO,同时生成l mol CH3OH,都表示正反应速率,自始至终都按1:1进行,故d错误;
故选:d;
②温度越高反应速率越快,到达平衡时间越短,故T1<T2,温度越高CO的转化率越小,升高温度平衡向逆反应移动,温度平衡常数降低,温度越高平衡常数越小,即K1>K2,
故答案为:>;
③由质子的定向移动可知左侧电极为燃料电池的负极,右侧电极为燃料电池的正极,负极发生氧化反应,甲醇在负极放电,故b通入CH3OH;正极反应还原反应,氧气在正极放电,正极反应式为O2+4e-+4H+=2H2O;6.4g甲醇(CH3OH)的物质的量为
| 6.4g |
| 32g/mol |
故答案为:CH3OH;O2+4e-+4H+=2H2O;1.2.
点评:本题考查化学平衡判断与移动、化学平衡常数、影响化学反应速率的因素、原电池等,综合性较大,难度中等,是对知识的综合利用,加强对基础知识理解掌握.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
 MnFe2O4-x+x/2_______
MnFe2O4-x+x/2_______ CO(g)+3H2(g);△H= +206.1 kJ/mol
CO(g)+3H2(g);△H= +206.1 kJ/mol 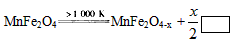 则框内的物质为:________; 第二步反应方程式为:
则框内的物质为:________; 第二步反应方程式为: H2+I2Ⅲ.2H2SO4=2SO2+O2+2H2O
H2+I2Ⅲ.2H2SO4=2SO2+O2+2H2O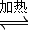 CH3OH(g)分析该反应并回答下列问题:
CH3OH(g)分析该反应并回答下列问题: