题目内容
【题目】化学中有许多的“守恒或相等“下列说法不正确的是
A. 化学反应中,反应物总能量与生成物总能量
B. 溶液中,阳离子电荷总数与阴离中电荷总数
C. 溶液中,稀释前后溶质质量与稀释后溶质质量
D. 化学反应中,参加反应物总质量与生成物总质量
【答案】A
【解析】A. 化学反应中有能量变化,反应物的总能量不等于生成物的总能量,故A错误;B. 电解质溶液中,溶液呈电中性,遵守电荷守恒规律,即阳离子电荷总数等于阴离子电荷总数,故B正确;C.溶液在浓缩或稀释前后溶质质量是不变的,故C正确;D. 在化学反应中,要遵守质量守恒定律,即参加反应的反应物总质量等于生成物的总质量,故D正确。

【题目】I.控制变量法是化学实验中的—种常用方法,如表是某课外兴趣小组研究等物质的量浓度的稀硫酸和锌反应的实验数据(计算结果精确到小数点—位),分析以下数据,回答下列问题:
序号 | 硫酸的体积 /mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的 时间/s | 生成硫酸锌的质量/g |
① | 50.0 | 2.0 | 薄片 | 15 | 200 | m1 |
② | 50.0 | 2.0 | 薄片 | 25 | 100 | m2 |
③ | 50.0 | 2.0 | 颗粒 | 25 | 70 | m3 |
④ | 50.0 | 2.0 | 颗粒 | 35 | 35 | m4 |
⑤ | 50.0 | 2.0 | 粉末 | 25 | t1 | 5.0 |
⑥ | 50.0 | 4.0 | 粉末 | 25 | t2 | m5 |
⑦ | 50.0 | 6.0 | 粉末 | 25 | t3 | 14.9 |
⑧ | 50.0 | 8.0 | 粉末 | 25 | t4 | 19.3 |
⑨ | 50.0 | 10.0 | 粉末 | 25 | t5 | 19.3 |
(1)实验①和实验②表明_____对反应速率有影响;研究锌的形状对反应速率的影响时,最好选取实验_______ (填3个实验序号)。
(2)下列数据推断正确的是______________________。
A. t1<70 B.t1>t4 C.m12 D.m6=19.3
(3)若采用与实验①完全相同的条件,但向反应窗口中滴加少量硫酸铜溶液,发现反应速率明显加快,原因是___________________________________。
(4)根据表中数据计算:硫酸的物质的量浓度是_________________mol/L。
II.己知在 25℃、l0l kPa 下,2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),现将 2molNO、2.4molCO通入恒容密闭容器中,反应过程中部分物质的浓度变化如图所示。
N2(g)+2CO2(g),现将 2molNO、2.4molCO通入恒容密闭容器中,反应过程中部分物质的浓度变化如图所示。
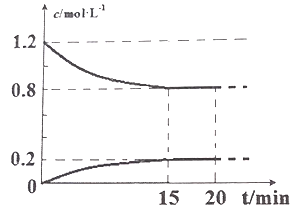
(1) 015min 内,v(CO2) =__________________。
(2)该反应的速率时间图像如下图中左图所示。若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图像如下图中右图所示。以下说法正确的是______(填对应字母)。
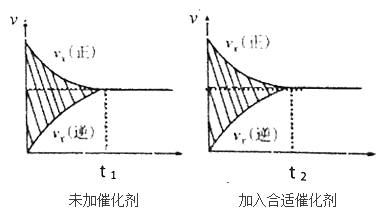
A.a1>a2 B.b12 C.t1>t2
(3) 一定条件下,己知反应NO2(g)+SO2(g) ![]() NO(g)+SO3(g),将NO2
NO(g)+SO3(g),将NO2
a.体系压强保持不变 b.混合气体颜色保持不变
c.NO2与SO2的体积比保持不变 d.每消耗lmol SO2的同时生成lmol NO
