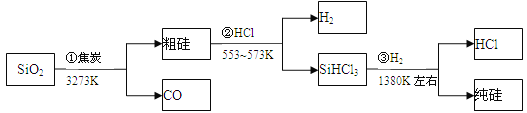
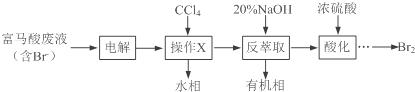
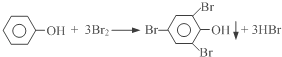
题目内容
【题目】假设反应N2+3H22NH3(正反应为放热反应) 的正反应速率是v1 , 逆反应速率是v2 , 当升高温度时,v1和v2的变化情况为( )
A.同时增大
B.v1减小,v2增大
C.同时减小
D.v1增大,v2减小
【答案】A
【解析】解:反应N2+3H22NH3(正反应为放热反应) 的正反应速率是v1 , 逆反应速率是v2 , 当反应温度升高时,增大活化分子的百分数,反应速率增大,v1和v2都增大,故选A.

练习册系列答案
 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
【题目】下表是周期表中的一部分,根据A—I在周期表中的位置,用元素符号或化学式回答下列问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | G | I | ||||
3 | B | C | F | H |
(1)中元素,化学性质最不活泼的是 ,只有负价而无正价的是 ,氧化性最强的单质是 ,还原性最强的单质是 ;
(2)最高价氧化物的水化物中碱性最强的是 ,酸性最强的是 ,呈两性的是 ;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的 ;
(4)在B、C、D、E、F、G、H中,原子半径最大的是 .最小的是 。