题目内容
【题目】(双选题)下列有关硫酸的化学事实与硫酸表现出的性质(括号中)的描述中,正确的是( )
A.久置在敞口容器中的浓硫酸,溶液质量增大(脱水性)
B.在加热条件下铁与浓硫酸反应(氧化性、酸性)
C.蔗糖与浓硫酸反应的“黑面包”实验(吸水性)
D.浓硫酸与氯化钠固体反应制HCl(难挥发性)
【答案】BD
【解析】浓硫酸的吸水性是指浓硫酸吸收现成的水,比如浓硫酸吸收空气中的水蒸气,所以A中应体现浓硫酸的吸水性,脱水性是指原物质中没有现成的水,浓硫酸把H、O按H2O的比例脱出来的性质,比如蔗糖炭化体现了浓硫酸的脱水性。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】磷和其化合物在科研及生产中均有着重要的作用。
(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)PCl5(g),反应过程如下:
2P(s) + 3Cl2(g) = 2PCl3(g) △H=-612kJ/mol
2P(s) + 5Cl2(g) = 2PCl5(g) △H=-798kJ/mol
气态 PCl5生成气态PCl3和Cl2的热化学方程式为________。
(2)一定温度下,在三个恒容体积均为2.0L的容器中发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
编号 | 温度(℃) | 起始/mol | 平衡/mol | 达到平衡所需时间/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
I | 320 | 0.40 | 0.10 | 0.10 | t1 |
II | 320 | 0.80 | t2 | ||
III | 410 | 0.40 | 0.15 | 0.15 | t3 |
①平衡常数K:溶液II____溶液III(填“>”或“=”或“<”)
②反应达到平衡时,PCl3的转化率:容器II_____容器I(填“>”或“=”或“<”)
(3)亚磷酸(H2PO5)与足量的NaOH溶液反应生成Na2HPO3。电解Na2HPO3溶液也可得到亚鱗酸,装置示意图如图:

阴极的电极反应式为_______;产品室中反应的离子方程式为__________。
(4)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26向浓度均为0.20 mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO3,先生成________沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于105mol/L)时,溶液中的另一种金属阳离子的物质的量浓度c= ______mol/L
【题目】亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强。
Ⅰ.经查:①Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10;②Ka(HNO2)=5.1×10-4。请设计最简单的方法鉴别NaNO2和NaCl两种固体______________________
Ⅱ. 某小组同学用如下装置(略去夹持仪器)制备亚硝酸钠
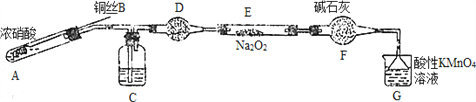
已知:①2NO+Na2O2=2NaNO2; ②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+。
(1)使用铜丝的优点是________________________。
(2)装置A中发生反应的化学方程式为_____________________________。
装置C中盛放的药品是_________;(填字母代号)
A.浓硫酸 B.NaOH溶液 C.水 D.四氯化碳
(3)该小组称取5.000g制取的样品溶于水配成250ml溶液,取25.00ml溶液于锥形瓶中,
用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次实验数据出现异常,造成这种异常的原因可能是_________(填字母代号)。
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为___________________。
③该样品中亚硝酸钠的质量分数为______________。