题目内容
5.Na2O2、CaC2、CaH2、FeS2均为离子化合物,前三种物质极易与水反应下列有关叙述中正确的是( )| A. | 1molNa2O2与水反应转移2mol电子 | |
| B. | CaH2在水中以Ca2+和H-离子形式存在 | |
| C. | 四种化合物晶体类型和化学键类型均相同 | |
| D. | FeS2阴离子电子式为 |
分析 A.反应中O元素化合价由-1价变化为0价;
B.CaH2与水反应生成氢氧化钙和氢气;
C.CaH2只含有离子键;
D.FeS2中含有S-S键.
解答 解:A.1molNa2O2与水反应生成氧气,由O元素的化合价从-1价升高为0可知,每反应1molNa2O2转移1mol电子,故A错误;
B.CaH2与水反应生成氢氧化钙和氢气,则溶液中不存在H-,故B错误;
C.CaH2只含有离子键,其它物质含有离子键和共价键,故C错误;
D.FeS2中含有S-S键,阴离子电子式为 ,故D正确.
,故D正确.
故选D.
点评 本题考查较为综合,涉及氧化还原反应、化学键、电子式等知识,为高频考点,侧重于双基的考查,注意把握CaH2的结构和性质,为易错点,难度不大.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
15.1克SO2含有n个O原子,则阿佛加德罗常数可表示为( )
| A. | 64n | B. | $\frac{1}{64}$n | C. | 32n | D. | $\frac{3}{64}$n |
16.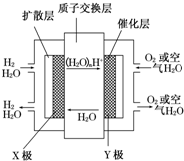 中国在2009年推出了国产燃料电池概念汽车,该车装有“绿色心脏”--质子交换膜燃料电池.如图是某科技杂志登载的该电池原理示意图.下列叙述正确的是( )
中国在2009年推出了国产燃料电池概念汽车,该车装有“绿色心脏”--质子交换膜燃料电池.如图是某科技杂志登载的该电池原理示意图.下列叙述正确的是( )
 中国在2009年推出了国产燃料电池概念汽车,该车装有“绿色心脏”--质子交换膜燃料电池.如图是某科技杂志登载的该电池原理示意图.下列叙述正确的是( )
中国在2009年推出了国产燃料电池概念汽车,该车装有“绿色心脏”--质子交换膜燃料电池.如图是某科技杂志登载的该电池原理示意图.下列叙述正确的是( )| A. | 工作时“X极”周围溶液的酸性增强 | |
| B. | 氢气在电极上发生还原反应 | |
| C. | 图中标出的“Y极”实际是原电池的负极 | |
| D. | 工作过程中,质子(H+)从“Y极”一边透过质子交换膜移动到“X极”一边与OH-反应生成水 |
13.(1)证明海带中含有碘元素的实验方案如表,请你按要求补充完整:
(2)利用新制氯水、1mol/L NaBr溶液、淀粉液、以及II中所得滤液,验证卤素单质氧化性的相对强弱.
V分别取5mL 1mol/L NaBr溶液于两支小试管中
Ⅵ向两支试管中分别滴加5滴新制氯水,溶液均变为黄色
ⅥⅠ向其中一支试管中继续滴加新制氯水,直至溶液变为棕红色
ⅥⅡ…
④请写出步骤VI中反应的离子方程式Cl2+2Br-=Br2+2Cl-;为验证溴的氧化性强于碘,步骤VIII的操作和现象是:将VI所得黄色溶液滴入II所得滤液中,溶液变为黄色,再加入淀粉溶液,溶液变为蓝色.
⑤步骤ⅥⅠ的目的是确认VI所得黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰.
⑥氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,电子层数依次增大,则原子半径逐渐增大,得电子能力逐渐减弱,非金属性减弱.
| 步骤 | 实验过程 | 实验用品 |
| Ⅰ | 将干海带灼烧灰化 |  |
| Ⅱ | 将海带灰溶解、过滤 |  和①玻璃棒(玻璃仪器名称) |
| Ⅲ | 氧化滤液中的I-,反应的离子方程式为②2I-+H2O2+2H+=I2+2H2O |  |
| Ⅳ | 取少量Ⅲ中反应后溶液于试管中,加入少量CCl4并振荡后静置,观察到③下层溶液变为紫红色,说明海带中含有碘元素. |  |
V分别取5mL 1mol/L NaBr溶液于两支小试管中
Ⅵ向两支试管中分别滴加5滴新制氯水,溶液均变为黄色
ⅥⅠ向其中一支试管中继续滴加新制氯水,直至溶液变为棕红色
ⅥⅡ…
④请写出步骤VI中反应的离子方程式Cl2+2Br-=Br2+2Cl-;为验证溴的氧化性强于碘,步骤VIII的操作和现象是:将VI所得黄色溶液滴入II所得滤液中,溶液变为黄色,再加入淀粉溶液,溶液变为蓝色.
⑤步骤ⅥⅠ的目的是确认VI所得黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰.
⑥氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,电子层数依次增大,则原子半径逐渐增大,得电子能力逐渐减弱,非金属性减弱.
20.下列有机物的系统命名正确的是( )
| A. | 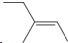 :3-甲基-2-戊烯 :3-甲基-2-戊烯 | B. |  :2-甲基-3-丁炔 :2-甲基-3-丁炔 | C. | 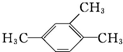 :1,3,4-三甲苯 :1,3,4-三甲苯 | D. |  :2-甲基-1-丙醇 :2-甲基-1-丙醇 |
10.AgCl悬浊液中存在溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq).向适量AgCl悬浊液中加入足量1mol/L的HI溶液,振荡后,大部分AgCl转化成了AgI,该反应过程说明( )
| A. | I-的还原性比Cl-强 | B. | AgI的溶解度比AgCl的溶解度大 | ||
| C. | 氢碘酸、盐酸均为强酸 | D. | AgI比AgCl更难溶 |
17.将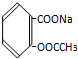 转变为
转变为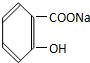 ,下列操作正确的是( )
,下列操作正确的是( )
 转变为
转变为 ,下列操作正确的是( )
,下列操作正确的是( )| A. | 与氢氧化钠共热后通足量的二氧化碳 | |
| B. | 溶解,加热通足量的二氧化硫气体 | |
| C. | 与稀硫酸共热后加足量氢氧化钠 | |
| D. | 与稀硫酸共热后加足量碳酸钠 |
 下面给出了四种烃A、B、C、D的相关信息:
下面给出了四种烃A、B、C、D的相关信息: