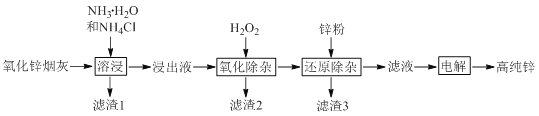
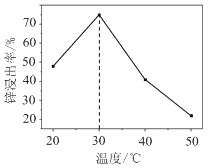
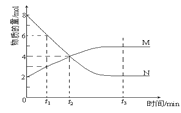
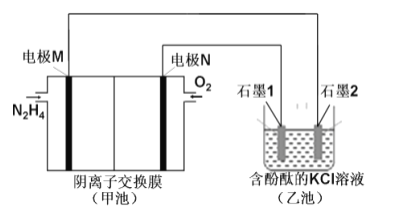
题目内容
【题目】①~⑤五种元素在元素周期表中的位置如下图所示:
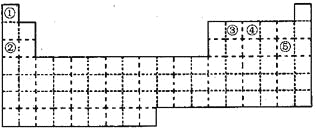
回答下列问题:
(1)①~⑤五种元素中,非金属性最强的元素在周期表中的位置是___________;
(2)②③④元素原子中,半径最小的是_________(填元素符号);
(3)元素①和③可以形成众成多的化合物,其中最简单的是_____(化学式)。该化合物中,化学键的类型为_________(选填“极性共价键”、 “非极性共价键”或“离子键”);
(4)元素④的最高价氧化物对应水化物能与其最低价的气态氢化物发生反应,产物是________(化学式);
(5)元素⑤单质与水反应的离子方程式:________________________________。
【答案】第三周期第VIIA族 N CH4 极性共价键 NH4NO3 Cl2+H2O=H++Cl-+HClO
【解析】
根据元素在周期表中的位置,可以知道①②③④⑤分别是H、Na、C、N、Cl元素,
(1)同周期自左而右元素的非金属性逐渐增强,同主族自上而下元素的非金属性逐渐减弱,所以这几种元素中非金属性最强的是Cl元素;
(2)同周期自左而右原子半径逐渐减小,同主族自上而下原子半径逐渐增大;
(3)元素①和③可以形成众成多的化合物,其中最简单的是CH4;
(4)元索④的最高价氧化物对应水化物为硝酸,其最低价的气态氢化物为氨气,二者反应生成硝酸铵;
(5)氯气和水反应生成HCl和HClO。
根据元素在周期表中的位置,可以知道①②③④⑤分别是H、Na、C、N、Cl元素,
(1)同周期自左而右元素的非金属性逐渐增强,同主族自上而下元素的非金属性逐渐减弱,所以这几种元素中非金属性最强的是Cl元素,Cl元素处于第三周期ⅦA族;因此,本题正确答案是:第三周期ⅦA族;
(2)同周期自左而右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,故原子半径:Na>C>N,因此,本题正确答案是:N;
(3)元素①和③可以形成众成多的化合物,其中最简单的是CH4;甲烷属于共价化合物,存在极性共价键;因此,本题正确答案是:CH4;极性共价键;
(4)元索④的最高价氧化物对应水化物为HNO3,其最低价的气态氢化物为NH3,二者反应生成NH4NO3;因此,本题正确答案是:NH4NO3;
(5)氯气和水反应生成HCl和HClO,反应的离子方程式为:Cl2+H2O=H++Cl-+HClO;因此,本题正确答案是:Cl2+H2O=H++Cl-+HClO。