题目内容
9.瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
(1)A仪器的名称是分液漏斗,所盛试剂是浓盐酸,漂白粉的有效成分是Ca(ClO)2(填化学式).
(2)漂白粉将在U形管中产生,其化学方程式是2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O.
(3)用漂白粉溶液浸泡过的有色布条,如晾晒在空气中,过一段时间,其漂白效果更好的原因是(用反应化学方程式表示)Ca(ClO)2+CO2+H2O=CaCO3+HCl
(4)D装置的作用是除去多余的Cl2,防止污染大气.
分析 (1)A仪器名称是分液漏斗,所盛放试剂是液体浓盐酸;漂白粉的有效成分为Ca(ClO)2;
(2)U形管中,氯气与氢氧化钙反应生成氯化钙、次氯酸钙与水;
(3)次氯酸钙与空气中二氧化碳、水反应得到HClO,漂白效果更好;
(4)尾气中含有氯气,直接排放会污染空气,D装置吸收氯气,防止污染.
解答 解:(1)A仪器名称是分液漏斗,所盛放试剂是液体浓盐酸;漂白粉的成分为CaCl2、Ca(ClO)2,漂白粉的有效成分为Ca(ClO)2,故答案为:分液漏斗;浓盐酸;Ca(ClO)2;
(2)U形管中,氯气与氢氧化钙反应生成氯化钙、次氯酸钙与水,反应方程式为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
(3)次氯酸钙与空气中二氧化碳、水反应得到HClO,漂白效果更好,反应方程式为:Ca(ClO)2+CO2+H2O=CaCO3+HCl,故答案为:Ca(ClO)2+CO2+H2O=CaCO3+HCl;
(4)尾气中含有氯气,直接排放会污染空气,D装置除去多余的Cl2,防止污染大气,故答案为:除去多余的Cl2,防止污染大气.
点评 本题考查氯气的制备、漂白粉有关问题、对装置的分析评价等,比较基础,明确物质的性质和反应的原理是解题关键,注意对基础知识的理解掌握.

练习册系列答案
相关题目
20.下列物质中都存在离子键、极性键和配位键的是( )
| A. | 氢氧化钠、过氧化钠、硫酸四氨合铜[Cu(NH3)4]SO4、氢化钠 | |
| B. | 硝酸铵、氢化铵、氢氧化二氨合银[Ag(NH3)2]OH、硫酸铵 | |
| C. | 硫酸、氢氧化钠、氮化钙、氢氧化钡 | |
| D. | 氯化铵、氢氧化钠、双氧水、过氧化钙 |
4.某试管中充满红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,对原来试管中盛装的气体判断不正确的是( )
| A. | 可能是N2与NO2的混和气体 | B. | 可能是N2与NO的混和气体 | ||
| C. | 可能是NO与NO2的混和气体 | D. | 可能是NO2一种气体 |
14.有机化学中取代反应的范畴很广.下列反应不属于取代反应范畴的是( )
| A. |  | |
| B. | CH3CH2CH2CHOHCH3$→_{△}^{浓硫酸}$CH3CH2CH=CHCH3+H2O | |
| C. | 2CH3CH2OH$→_{140℃}^{浓H_{2}SO_{4}}$CH3CH2OCH2CH3+H2O | |
| D. | CH3COOH+CH3OH $→_{△}^{浓H_{2}SO_{4}}$ CH3COOCH3+H2O |
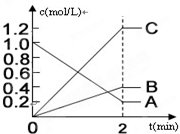 (1)铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸.工作时该电池总反应式为PbO2+Pb+2H2SO4═2PbSO4+2H2O,据此判断:
(1)铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸.工作时该电池总反应式为PbO2+Pb+2H2SO4═2PbSO4+2H2O,据此判断: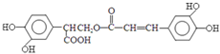
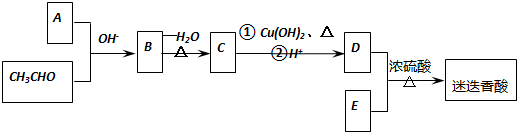
 $→_{-H_{2}O}^{△}$
$→_{-H_{2}O}^{△}$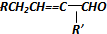
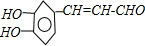 .
. .
.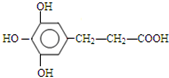 、
、 、
、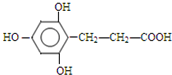 、
、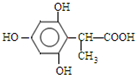 (任一种).
(任一种).
 ;
; (其中两种)(任意两种)
(其中两种)(任意两种)
 ,该反应的反应类型是取代反应.
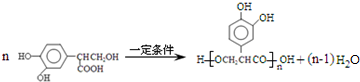
,该反应的反应类型是取代反应. )的路线如下图所示:
)的路线如下图所示:
 +3NaOH$\stackrel{△}{→}$$\stackrel{△}{→}$$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$$\stackrel{△}{→}$$\stackrel{△}{→}$ +NaCl+2H2O;
+NaCl+2H2O;  ,写出其余的同分异构体的结构简式
,写出其余的同分异构体的结构简式 、
、 .
.