题目内容
A、B、C、D四种化合物其焰色反应均为紫色,A、B、C和盐酸反应均得到D,将固体C加热可得到A,若向A的溶液中通入一种无色无味气体,又可制得C,若B与C的溶液混合可制得A,试推断:
(1)A是________,B是________,C是________,D是________。
(2)完成有关化学方程式:
C→A________________,A→C________________, B+C→A________________。
(1)A是碳酸钾,B是氢氧化钾,C是碳酸氢钾,D是氯化钾。
(2) C→A 2KHCO3==K2CO3+CO2+H2O,
A→C K2CO3+CO2+H2O ==2KHCO3,
B+C→A KOH+KHCO3==K2CO3+H2O
解析试题分析:A、B、C、D四种化合物其焰色反应均为紫色,说明都含有钾元素。A、B、C和盐酸反应均得到D,则D是氯化钾。将固体C加热可得到A,若向A的溶液中通入一种无色无味气体,又可制得C,所以联系碳酸氢钠和碳酸钠的转化可知,A是碳酸钾,C是碳酸氢钾。B与C的溶液混合可制得A,所以B是氢氧化钾。
考点:考查钾的化合物之间的转化、方程式的书写
点评:该题是基础性试题的考查,难度不大。试题注重基础,兼顾能力的培养。有利于培养学生的逻辑推理能力,提高学生分析问题、解决问题的能力。也有利于提高学生的应试能力,提高学习效率。

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
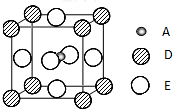 (2010?泰州三模)已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d84s2.
(2010?泰州三模)已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d84s2.