题目内容
[化学-选修物质结构与性质]A、B、C、D四种元素的原子序数依次递增,A、B元素的基态原子L电子层中末成对电子数分别为3、2.短周期主族元素中C元素的电负性最小,原子半径最大.D元素的原子序数是C元素的两倍,其合金多用于航天工业,被称为继铁、铝之后的第三金属,请回答下列问题:
(1)A、B、C三种元素的第一电离能由大到小顺序是 (填元素符号).
(2)D元素基态原子的介电子排布式是 ;
(3)白色晶体白色晶体C3AB4、可由CAB2和C2B2在银皿中于300℃条件下七天后制得,该白色晶体白色晶体C3AB4中阴离子的空间立体构名称是 ,其中心原子的杂化轨道类型是 杂化,中学化学常见的阴离子中,与该阴离子互为等电子体的离子符号是 (只填两种).该白色晶体遇潮湿的二氧化碳时发生剧烈反应,写出三种反应物按等物质的量发生反应,生成三种等物质的量且均含C元素的固体产物的化学方程式 ;
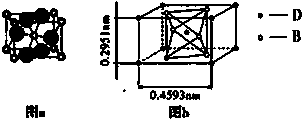
(4)B、D两元素组成的某种化合物的晶体结构(晶胞示意图)如图a、图b所示,写出该化合物的化学式 .
(1)A、B、C三种元素的第一电离能由大到小顺序是
(2)D元素基态原子的介电子排布式是
(3)白色晶体白色晶体C3AB4、可由CAB2和C2B2在银皿中于300℃条件下七天后制得,该白色晶体白色晶体C3AB4中阴离子的空间立体构名称是
(4)B、D两元素组成的某种化合物的晶体结构(晶胞示意图)如图a、图b所示,写出该化合物的化学式

分析:A、B、C、D四种元素的原子序数依次递增,A、B元素的基态原子L电子层中末成对电子数分别为3、2,则A原子核外电子排布式为1s22s22p3,A为氮元素;B的原子序数大于氮元素,则B原子核外电子排布式为1s22s22p4,B为氧元素;短周期主族元素中C元素的电负性最小,原子半径是大,则C为Na元素;D元素的原子序数是C元素的两倍,则D原子序数为22,为Ti元素,据此解答.
解答:解:A、B、C、D四种元素的原子序数依次递增,A、B元素的基态原子L电子层中末成对电子数分别为3、2,则A原子核外电子排布式为1s22s22p3,A为氮元素;B的原子序数大于氮元素,则B原子核外电子排布式为1s22s22p4,B为氧元素;短周期主族元素中C元素的电负性最小,原子半径是大,则C为Na元素;D元素的原子序数是C元素的两倍,则D原子序数为22,为Ti元素;
(1)氮元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,结合金属性越强第一电离能越小,则第一电离能由大到小顺序是N>O>Na,
故答案为:N>O>Na;
(2)Ti元素原子核外电子数为22,其基态原子的价电子排布式是3d24s2,故答案为:3d24s2;
(3)该白色晶体为Na3NO4,NO43-离子中N原子价层电子对数=4+
=4,N原子没有孤对电子,故其为正四面体结构,N原子采取sp3杂化,原子总数与价电子总数相同的微粒即为等电子体,利用代换法,可知与NO43-离子互为等电子体的离子有:PO43-、SO42-、ClO4-等,该白色晶体遇潮湿的二氧化碳时发生剧烈反应,三种反应物按等物质的量发生反应,生成三种等物质的量且均含Na元素的固体产物,应生成硝酸钠、氢氧化钠、碳酸氢钠,反应方程式为:Na3NO4+H2O+CO2=NaNO3+NaOH+NaHCO3,
故答案为:正四面体;sp3;PO43-、SO42-、ClO4-等;Na3NO4+H2O+CO2=NaNO3+NaOH+NaHCO3;
(4)由图b可知,晶胞中Ti原子位于体心与顶点上,O原子位于上下两个面上及体内(有2个),故晶胞中Ti元素数目=1+8×
=2、O原子数目=2+4×
=4,故该化合物化学式为TiO2,
故答案为:TiO2.
(1)氮元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,结合金属性越强第一电离能越小,则第一电离能由大到小顺序是N>O>Na,
故答案为:N>O>Na;
(2)Ti元素原子核外电子数为22,其基态原子的价电子排布式是3d24s2,故答案为:3d24s2;
(3)该白色晶体为Na3NO4,NO43-离子中N原子价层电子对数=4+
| 5+3-2×4 |
| 2 |
故答案为:正四面体;sp3;PO43-、SO42-、ClO4-等;Na3NO4+H2O+CO2=NaNO3+NaOH+NaHCO3;
(4)由图b可知,晶胞中Ti原子位于体心与顶点上,O原子位于上下两个面上及体内(有2个),故晶胞中Ti元素数目=1+8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:TiO2.
点评:本题物质结构与性质,涉及核外电子排布、电离能、杂化轨道与微粒结构、等电子体、晶胞计算等,推断元素是解题关键,注意掌握等电子体的概念,难度中等.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案
相关题目
 (2011?新余二模)化学--选修物质结构与性质
(2011?新余二模)化学--选修物质结构与性质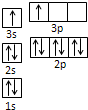
 [化学-选修物质结构与性质]
[化学-选修物质结构与性质]